- 🚛 В наличии на складе
-
COVID-19
- Средства индивидуальной защиты
- Кабина дезинфекции
- Ультрафиолетовый облучатель
- Термометр медицинский
- Измеритель АД
- Аппараты ИВЛ
- Увлажнитель кислорода
- Монитор пациента
- Шприцевой насос
- Аспиратор электрический
- Анализатор газов в крови
- Спирометр Пульсоксиметр
- Реабилитация лёгочной дисфункции пациентов, перенёсших Covid-19.
- Аппараты НИВЛ
- Диагностика
- Физиотерапия
- Криотерапия
- Контрпульсация (УНКП)
- Литотриптеры
-
Тепло и грязелечение
- Автоматизированные кухни для Теплолечения
- Система с подогревом для релаксации и грязевых аппликаций Aqua-Relax
- Система для релаксации с нагретым песком Sand Relax
- Инфракрасный теплоизлучатель Theramed 4
- Автоматизированные кухни для Грязелечения
- Мини−кухни для Применения Пакетированных Грязевых Аппликаций
- Системы для Обертываний «Velvet»
- Система пелоидотерапии конечностей
- Одноразовые грязевые аппликации
- Косметология
- Активное долголетие
- Хирургия
- Ветеринария
-
Реабилитация
- Тренажер с универсальной нагрузкой EN-Tree Pulley MDD
- Подвес реабилитационный «Орторент М»
- Аппарат для механотерапии «ОРТОРЕНТ» модель «Актив»
- Аппарат двигательный «Орторент-лучезапястный»
- Тренажер «Орторент Carmina»
- Электростимулятор Cefar Rehab X2
- Система электротерапии VitalStimPlus
- Беговая дорожка детская с БОС «Орторент»
Остеопороз
А. А. Мурадянц, Н.А. Шостак
ОСТЕОПОРОЗ (ОП) – хроническое системное метаболическое заболевание скелета, характеризующееся прогрессирующим уменьшением костной массы и ухудшением качества кости, что приводит к снижению её прочности и высокому риску переломов.
Основные детерминанты прочности кости:
- минеральная плотность кости (МПК),
- макро- и микроархитектура кости,
- размеры (геометрия) кости.
Микроструктурные нарушения при ОП затрагивают, как трабекулярную, так и кортикальные слои. Характерно уменьшение толщины трабекул, их количества и формы, увеличение расстояния между ними; также наблюдается уменьшение толщины кортикального слоя и повышение её пористости. Всё это приводит к возникновению микроповреждений и снижению устойчивости кости, что в целом повышает риск переломов.
В настоящее время ОП и ассоциированные с ним переломы считаются одной из главных причин снижения качества жизни, инвалидности и преждевременной смертности лиц пожилого возраста.
ИСТОРИЯ ВОПРОСА.
В 1770 году английский хирург John Hunter впервые высказал мысль о том, что кость - это постоянно обновляющаяся структура, в которой процессы разрушения и образования костной ткани протекают в тесной взаимосвязи между собой. Термин «остеопороз» впервые был использован в 1830 году французским патологом Jean Martin Lobstein при описании кости с выраженной порозностью. Однако только через 100 лет ОП стал рассматриваться как самостоятельное заболевание. Заслуга в этом принадлежит американскому врачу и эндокринологу Fuller Albright, который впервые представил описание постменопаузального ОП, указав на его связь с менопаузой, эстрогенной недостаточностью и кальций-фосфорными нарушениями (Albright F, Bloomberg E, Smith P.H. Post-menopausal osteoporosis. Trans Assoc Am Physicians. 1940;55,4:298-305). Также F. Albright были предприняты первые попытки лечения ОП при помощи инъекций эстрогенов.
ЭПИДЕМИОЛОГИЯ.
- Более чем 75 миллионов людей в Европе, Японии и США страдает ОП. В России, по данным эпидемиологических исследований, ОП диагностируется у 30,5% - 33,1% женщин в возрасте 50 лет и старше, а у 24% из них наблюдается, по крайней мере, один клинически выраженный перелом.
- Среди страдающих ОП 80% составляют женщины и только 20% мужчины. С возрастом частота ОП возрастает. Жизненный риск остеопоротических переломов у женщин в 3-6 раз выше, чем у мужчин.
- Ежегодно во всем мире по причине ОП происходит 8,9 миллионов переломов костей, из которых 4,5 миллионов – приходится на долю Европы и США (ВОЗ, 2004 г). К 2025 году ожидается более чем двукратное их увеличение.
- По данным National Osteoporosis Foundation (NOF) к 2005 году расходы, связанные с лечением остеопоротических преломов составили $19 миллиардов, а к 2025 году достигнут $25,3 миллиардов.
КЛАССИФИКАЦИЯ
ОП - междисциплинарная проблема, с которой сталкиваются врачи различных специальностей. По МКБ – 10 пересмотра ОП отнесён к XIII классу «Болезни костно-мышечной системы и соединительной ткани».
М80-М85. Нарушение плотности и структуры кости
М80. Остеопороз с патологическим переломом
М81. Остеопороз без патологического перелома
М82. Остеопороз при болезнях, классифицированных в других рубриках
Клиническая классификация Российской ассоциации по остеопорозу (1997 г.)
- Первичный остеопороз
- Постменопаузальный (1-го типа)
- Сенильный (2-го типа)
- Ювенильный
- Идиопатический
- Вторичный остеопороз
- Ревматические заболевания: ревматоидный артрит, системная красная волчанка, анкилозирующий спондилоартрит.
- Эндокринные заболевания: эндогенный гиперкортицизм (синдром Иценко-Кушинга), тиреотоксикоз, гипогонадизм, сахарный диабет, гиперпаратиреоз, гипопитуитаризм.
- Нефрологические заболевания: хроническая почечная недостаточность, синдром Фанкони.
- Заболевания органов пищеварения: мальабсорбция, хронические заболевания печени и т.д.
- Гематологические заболевания: миеломная болезнь, талассемия, лейкозы, лимфомы.
- Генетические нарушения: несовершенный остеогенез, синдром Марфан и др.
- Лекарственный остеопороз: глюкокортикостероиды, иммунодепрессанты, антиконвульсанты (финлепсин), агонисты гонадотропин-рилизинг гормона, антациды содержащие алюминий, тиреоидные гормоны.
- Другие заболевания и состояния: ХОБЛ, алкоголизм, иммобилизация, овариоэктомия, нервная анорексия, нарушения питания, трансплантация органов.
ЭТИОЛОГИЯ
ОП - многофакторное заболевание, развитие которого определяют генетические, гормональные, конституциональные и внешнесредовые факторы. Вариабельность костной массы, как и особенности строения кости на 80% генетически детерминированы. Гормональный статус, средовые факторы (особенности питания, образа жизни, физической активности, вредные привычки и др.) оказывают значительное влияние на достижение максимального уровня костной массы и дальнейшие темпы его снижения. Развитию ОП также способствуют различные хронические заболевания (ревматические, эндокринные и т.д.), прием некоторых лекарственных средств.
ПАТОГЕНЕЗ
Костная система является сложной, динамически изменяющейся структурой с активными метаболическими процессами. На протяжении всей жизни в ней постоянно протекают процессы формирования и резорбции (разрушения), составляющие цикл ремоделирования костной ткани. Продолжительность цикла костного ремоделирования составляет около 6 мес. В течение года обновляется примерно 10% костной ткани. Нарушение баланса между резорбцией кости и её образованием приводит к возникновению различных форм скелетной патологии, в том числе и ОП.
Ремоделирование кости является возраст-зависимым процессом. В пубертатном и постпубертатном периоде (период роста) костная масса активно увеличивается, достигая своего максимального значения или пика к 20-30 годам. Установлено, что чем выше уровень пиковой костной массы, тем менее значимы её дальнейшие потери с возрастом и тем меньше риск развития ОП. Вариабельность пиковой костной массы зависит от многих экзо- и эндогенных факторов ( генетические, гормональные, физическая активность, достаточное поступление кальция и др.).
После завершения периода роста и развития скелета наступает период стабилизации. В этот период процессы формирования кости и резорбции происходят с одинаковой интенсивностью и плотность кости не претерпевает значительных изменений. Физиологическое снижение костной массы начинается с 35 лет и резко возрастает в первые 5-10 лет после менопаузы. В этот период женщины теряют до 20% костной массы. Фактором, определяющим эти изменения, является дефицит эстрогенов.
Как известно, эстрогены являются мощными системными факторами подавляющими костную резорбцию. Дефицит эстрогенов приводит к уменьшению ингибирующего влияния на остеокласты и снижению активности остеобластов, повышению чувствительности костных клеток к действию паратиреоидного гормона, прорезорбтивных цитокинов (ИЛ-1, -6, -11, ФНО-a и др.), что способствует ускорению и разобщению процессов костного ремоделирования.
С 65-70 лет, темпы потерь костной массы замедляются и составляют всего 0,3-0,5% в год. Это обусловлено, прежде всего, инволютивными механизмами, приводящими к уменьшению продолжительности жизни остеоцитов, снижению активности остеобластов, развитию атрофических процессов в костной ткани. К факторам, ускоряющим в этот период деминерализацию кости относят дефицит кальция и витамина D, которым страдает более % женщин старше 70 лет, развитие вторичного гиперпаратиреоза, снижение физической активности. Помимо количественных потерь с возрастом кость претерпевает и существенные качественные изменения.
Факторы риска ОП. Структурно-функциональное состояние костной ткани, в постменопаузальный период определяют уровень пиковой костной массы, достигнутый в молодые годы, а так же воздействие внешних (модифицируемых) и внутренних (немодифицируемых) факторов способствующих чрезмерной её потере (табл.1). Определённое влияние на состояние костной ткани оказывают факторы, связанные с репродуктивной функцией женщин (первичное бесплодие, позднее менархе (старше 15 лет), олиго- аменорея и др.). Однако их значение в развитие ОП остаётся до конца не выясненным.
Табл.1. Доказанные факторы риска остеопороза
|
Немодифицируемые |
Модифицируемые |
|
|
ОТДЕЛЬНЫЕ ФОРМЫ ОСТЕОПОРОЗА.
Постменопаузальный остеопороз (ПМО) наиболее распространенная форма заболевания, при котором прогрессирующее снижение прочности кости ассоциировано с наступлением менопаузы (естественной или хирургической). ПМО относится к первичному остеопорозу I типа и характеризуется высоким уровнем костного метаболизма, при котором интенсивные процессы резорбции не компенсируется нормальным или повышенным процессом костеобразования. Данной формой ОП страдают преимущественно женщины 50-70 лет. Отличительной особенностью ПМО является преимущественное поражение трабекулярной (губчатой) костной ткани (позвонки, дистальный отдел лучевой кости).
Сенильный ОП наблюдается у лиц старше 70 лет и проявляется переломами проксимального отдела бедра. Сенильный ОП относится к первичному ОП II типа, для которого характерен низкий уровень костного метаболизма с преимущественным снижением процессов костеобразования. Уменьшение костной массы при сенильном ОП происходит пропорционально как в трабекулярной, так и в кортикальной кости.
Ювенильный ОП – относится к редким и малоизученным заболеваниям костной системы, которой страдают дети и подростки. Ювенильный ОП развивается за 2-3 года до пубертатного периода. Клинически проявляется болями в костях и переломами, включая компрессионные переломы позвоночника, дорсальным кифосколиозом, деформацией грудной клетки по типу «куриная» грудь, нарушением походки. При биохимическом исследовании наблюдается отрицательный кальциевый баланс. Диагноз ювенильного ОП устанавливается при исключении врожденных заболеваний скелета, и в первую очередь несовершенного остеогенеза, как наиболее частой причины компрессионных переломов в детском возрасте, различных форм рахита, ювенильной болезни Педжета, костного туберкулеза, остеомиелита.
Идиопатический ОП – ОП взрослых неясной этиологии, развивается преимущественно у мужчин в возрасте 25-60 лет и у женщин в пременопаузе (от 20 лет до менопаузы).Соотношение взрослых мужчин и женщин с идиопатическим ОП составляет 10:1. Диагноз идиопатический ОП устанавливается только при исключении всех возможных причин вторичного ОП и других метаболических остеопатий.
Остеопороз у мужчин – малоизученная форма ОП, которая практически в равном проценте случаев относится либо к идиопатическому, либо к вторичному ОП. Потери костной массы у мужчин начинаются в более позднем возрасте, чем у женщин и происходят более медленно. У них отсутствуют такие феномены как беременность, лактация и менопауза. Мужчины отличаются лучшей геометрией кости (шейки бедра), более массивным костным скелетом, большей пиковой костной массой, что делает их менее подверженными ОП и переломам. Вместе с тем, установлено, что смертность от переломов бедра, в течение первого года у мужчин в 2 раза выше, чем у женщин. А жизненный риск остеопоротических переломов для мужчин 60-ти лет оценивается в 25%. Выделяют следующие факторы риска ОП у мужчин:
- Гипогонадизм (первичный или вторичный)
- Низкий уровень физической активности
- Курение
- Злоупотребление алкоголем
- Дефицит кальция и витамина D
- Астеническое телосложение
- Заболевания желудочно-кишечного тракта (ЖКТ)
Вторичный ОП обусловлен различными заболеваниями или связан с длительным приемом ряда лекарственных препаратов. По некоторым оценкам, вторичный ОП составляет 60% от всех случаев ОП у мужчин, примерно половину всех случаев ОП у женщин в пременопаузе и встречается у 20% женщин в постменопаузе. Наиболее распространенной формой вторичного ОП является глюкокортикоидный ОП (ГК — ОП), которому подвержены до 30 - 50% пациентов. ГК, являясь одними из эффективных препаратов в лечении иммуновоспалительных заболеваний, в то же время, занимают лидирующее место среди причин вторичного ОП. Доказано, что не существует «безопасной» дозы ГК и даже прием 2,5-7,5 мг/сут в эквиваленте к преднизолону продолжительностью более 3 мес способствует снижению МПК и значительному повышению риска переломов позвоночника и шейки бедра.
Клинические особенности ГК - ОП:
- преимущественно бессимптомное течение;
- максимальное снижение МПКТ в первые месяцы ГК-терапии;
- возникновение переломов при более высоких значениях МПКТ, чем при первичном ОП.
ОП при ревматоидном артрите (РА). Развитие ОП является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота ОП у больных РА в 2-3 раза выше, чем в популяции. Снижение костной массы при РА отражает патологическое влияние системного аутоиммунного воспаления на костный метаболизм. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции. Потери костной массы при РА могут носить как локальный (периартикулярный), так и системный (генерализованный) характер. Периартикулярный ОП является одним из ранних рентгенологических признаков РА и рассматривается в качестве предиктора суставной деструкции. Системный ОП, по мнению ряда авторов, также быстрее прогрессирует в первые годы болезни и отражает тяжесть течения РА.
Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска. Несмотря на многочисленные исследования, вклад каждого из них в процесс снижения костной массы оценить сложно ввиду тесного их взаимодействия. Среди общих факторов наибольшим весом обладают - пожилой возраст, менопауза, низкая масса тела, а также низкая физическая активность, которая у больных РА коррелирует с тяжестью функциональных нарушений. Из специфических факторов наибольшее значение имеют активность воспалительного процесса, тяжесть функциональных нарушений, длительность болезни и прием ГК.
Критерии отбора больных РА с высоким риском ОП (Haugeberg G.et al., 2002):
- Женщины > 50 лет, мужчины > 60 лет
- СОЭ > 20 мм/час или СРБ > 20 мг/л
- Функциональный статус: счет Штейнброкера > 3 или счет HAQ > 1,25
- Вес < 60 кг
- Прием ГК
Наличие, по крайней мере 3-х из 5 критериев позволяет предположить у больного ОП и направить его на денситометрию.
КЛИНИЧЕСКАЯ КАРТИНА
Для ОП характерно бессимптомное течение более чем в 50% случаев, что позволило именовать его «безмолвной» болезнью. Как правило, первыми клиническими проявлениями ОП бывают его осложнения – вертебральные и вневертебральные переломы.
|
КЛИНИЧЕСКИЕ СИМПТОМЫ ОСТЕОПОРОЗА |
|
Боль в спине.Возникновение боли в спине у больных ОП ассоциировано с компрессионной деформацией или переломом тел позвонков. Отмечено, что выраженность компрессии позвонков не всегда коррелирует с интенсивностью болей в позвоночнике. Боли в спине могут иметь острый (до 12 нед) или хронический характер (более 12 нед).
Факторы, влияющие на развитие хронической боли в спине при ОП:
- Микро- и макропереломы позвонков
- Сдавление и тоническое напряжение мышечно-связочного аппарата
- Кифотическая деформация позвоночника
- Давление ребер на гребни подвздошных костей
- Вторичные дегенеративные изменения в структурах позвоночно-двигательного сегмента (межпозвоночных суставах, дисках и т.д.)
- Психогенный фактор
Снижение роста более чем на 2,5 см за год, или на 4 см и более в сравнении с ростом в 25 лет позволяют предположить у пациента остеопоротический перелом позвонков.
Грудной кифоз («вдовий горб») – наиболее частое изменение осанки у пациентов с ОП. Увеличение грудного кифоза обусловлено множественными деформационными изменениями тел позвонков грудного и поясничного отделов позвоночника. На поздних этапах болезни компенсаторно развивается гиперлордоз поясничного отдела. Кифотическая деформация позвоночника, переломы поясничных позвонков приводят к уменьшению расстояния между ребрами и гребнями подвздошных костей и развитию илео-костального синдрома.
Перечисленные клинические симптомы ОП имеют ограниченную диагностическую ценность и позволяют лишь заподозрить ОП и связанные с ним переломы позвонков.
Остеопоротические переломы. Типичными для ОП считаются переломы шейки бедра, позвонков и дистального отдела предплечья. К нетипичым для ОП переломам относят: переломы черепа, костей лица, пальцев верхних и нижних конечностей, копчика. Отличительной особенностью остеопоротических переломов является развитие их при минимальной травме, т.е. произошедших спонтанно или при падении с высоты не выше собственного роста человека. Вертебральные переломы могут быть как бессимптомными или морфометрическими, так и сопровождаться развитием острых и хронических болей в спине (симптоматические или клинические переломы). Развитие низкотравматичных переломов костей является мощным предиктором последующих переломов и указывает на тяжёлое течение ОП. Так, при переломах позвонков риск последующих переломов любых локализаций повышается в 2,8 раз, а риск повторных переломов позвонков – в 5,4 раза. Согласно рекомендациям Российской ассоциации по остеопорозу (2005г), у женщин старше 70 лет, перенесших перелом вследствие минимальной травмы, диагноз ОП может быть выставлен без денситометрического исследования (уровень доказательности А).
ДИАГНОСТИКА
Диагностика ОП – это комплекс мероприятий включающий:
- расспрос и тщательный сбор анамнеза с определением факторов риска ОП и возможных причин вторичного ОП;
- физикальный осмотр с обязательным определением антропометрических данных больного (вес, рост);
- рентгенографическое исследование грудного и поясничного отделов позвоночника в боковой проекции;
- исследование МПК поясничного отдела позвоночника и проксимального отдела бедра методом двухэнергетической рентгеновской абсорбциометрии;
- дифференциальный диагноз ОП, исключение других форм метаболических остеопатий.
РЕНТГЕНОГРАФИЧЕСКАЯ ДИАГНОСТИКА.
Рентгенологические признаки ОП позвоночника:
- Увеличение рентгенопрозрачности тел позвонков
- Истончение кортикального слоя, подчеркнутость замыкательных пластинок
- Исчезновение трабекулярного рисунка, уменьшение или исчезновение поперечной и усиление вертикальной исчерченности тел позвонков
- Рамочная структура позвонка (симптом «оконной рамы»)
- Характерные деформации позвонка (рис.1)
- Компрессии чаще локализуются в Th11, Th12 и L1(рис.2)
- Измененные позвонки часто чередуются с малоизмененными или неизмененными позвонками (симптом «клавиш»)
Задачи рентгенографического метода в диагностике ОП:
- выявление предшествующих или текущих вертебральных и вневертебральных переломов;
- динамическое наблюдение за появлением новых переломов;
- дифференциальная диагностика остеопоретических переломов от других типов деформаций позвонков.
Для этого проводят латеральную рентгенографию поясничного (L1-L4) и грудного (Th4-Th12) отделов позвоночника. Снижение высоты позвонка более чем на 20% (или 4 мм) при латеральной рентгенографии позвоночника позволяет заподозрить вертебральный перелом. Для оценкихарактера, глубины и распространенности деформационных изменений тел позвонков используют рентгеноморфометрический метод.
Недостатки стандартной рентгенографии:
- метод не пригоден для ранней диагностики заболевания, так как выявляет признаки ОП при потере не менее 30 % костной массы;
- не позволяет оценить динамику изменений в костной ткани на фоне терапии.
Передняя клиновидная деформация
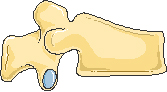
Двояковогнутая деформация или деформация по типу «рыбьего» позвонка
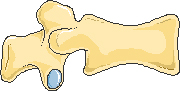
Задняя клиновидная деформация
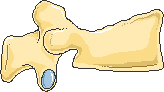
Компрессионная деформация
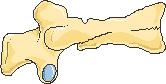
Рисунок 1. Типичные деформации тел позвонков при остеопорозе
Рисунок 2. Тяжелый компрессионный перелом Th-12 позвонка у пациентки с глюкокортикоидным остеопорозом.
ОСТЕОДЕНСИТОМЕТРИЯ. Исследование МПК позволяет установить диагноз ОП, оценить его тяжесть и риск переломов. Существуют различные методы определения костной плотности, однако «золотым стандартом» в определении МПК признана двухэнергетическая рентгеновская абсорбциометрия ( Dual Energy X-ray Absorbtiometry или DЕXA).
Показания для проведения остеоденситометрии:
- Женщины 65 лет и старше вне зависимости от факторов риска
- Мужчины в возрасте 70 лет и старше
- Женщины моложе 65 лет в постменопаузе, имеющие один и более фактор риска
- Взрослые с переломами при минимальной травме в анамнезе
- Взрослые, принимающие препараты или имеющие заболевания, приводящие к снижению костной массы
- Мониторинг эффективности терапии ОП
Для оценки МПК исследуется проксимальный отдел бедренной кости (Neck- шейка бедренной кости, Wards – область Варда, Troch – большой вертел, Тоtаl – суммарный показатель) и поясничный отдел позвоночника L1-L4 (рис.3). Результаты исследования выражаются в граммах минерала на единицу площади сканирования (г/см2). Наряду с абсолютными показателями плотности кости в результатах денситометрии автоматически вычисляются Т- и Z- критерии в процентах и величинах стандартного отклонения ( SD). Т-критерий представляет собой количество стандартных отклонений от среднего значения МПК здоровых лиц в возрасте 20-40 лет. Z-критерий оценивает количество стандартных отклонений в сравнении с нормативными показателями для аналогичного исследуемым лицам возраста и пола. По рекомендации ВОЗ диагноз ОП устанавливается на основании результатов исследования МПК методом DЕXA, используя для этого данные Т-критерия.
|
Критерии остеопороза (ВОЗ, 1994г.) по данным измерения МПК: |
|
Критерии ОП разработаны ВОЗ в основном для женщин европеоидной расы в постменопаузе, но могут быть применимы и для мужчин старше 50 лет. Согласно рекомендациям Международного общества клинической денситометрии (ISCD,2004г) в оценке МПК у женщин в пременопаузе и у молодых мужчин, а также у детей и подростков обоего пола предпочтительнее использовать Z-критерий. Диагноз ОП в этом случае устанавливается только при сочетании низких показателей МПК (Z-критерий < -2 SD) с факторами риска ОП.
Рисунок 3. Заключения денситометрического исследований проксимального отдела правой бедренной кости (А) и поясничного отдела позвоночника (Б) методом DXA
( 1 – график референсной базы данных и результатов исследования пациента; 2 – таблица сравнительной оценки МПК по T- и Z-критериям, на основании которой формулируется заключительный диагноз ).
ОЦЕНКА АБСОЛЮТНОГО РИСКА ПЕРЕЛОМОВ
Считается, что способность МПК предсказывать перелом, сопоставима с использованием показателей артериального давления для прогнозирования инсульта. При снижении МПК на 1 стандартное отклонение риск переломов возрастает в 1,5-3 раза. Однако снижение костной массы является важной, но не единственной причиной повышения риска переломов. Вклад в повышение риска вносят независимые от МПК клинические факторы риска (КФР) переломов.
Клинические факторы риска переломов (European guidance for the diagnosis and management of osteoporosis in postmenopausal women, 2008):
- Возраст
- Пол
- Низкий индекс массы тела
- Предшествующие низкотравматичные переломы (особенно бедра, лучевой кости и позвоночника)
- Семейный анамнез переломов бедра
- Лечение ГКС ( > 5 мг преднизолона ежедневно в течение 3 мес и более)
- Курение
- Прием алкоголя 3 единицы и более ежедневно (1 единица = 8-10г алкоголя; 3 единицы = 285 мл пива или 30 мл спирта, или 120 мл вина, или 60 мл аперитива )
- Вторичные причины остеопороза (прежде всего РА)
ВОЗ был предложен FRAX-алгоритм позволяющий рассчитать 10-летнюю вероятность развития переломов для мужчин и женщин при использовании отдельных клинических факторов риска и их количества, а также значений МПК по Т-критерию (таб.2,3,4). Риск будущего перелома считается высоким при значении абсолютного риска > 20%, средний — от 10 до 20%, низкий - < 10%. Компьютерная программа по расчету риска переломов представлена на сайтеwww.shef.ac.uk/FRAX.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Необходимые лабораторные исследования до начала терапии ОП:
- Клинический анализ крови, общий анализ мочи
- Биохимический анализ крови с обязательным определением креатинина и скорости клубочковой фильтрации
- Определение кальция (свободного и ионизированного), фосфора, костной щелочной фосфатазы в сыворотке крови
- Суточная экскреция кальция и фосфора с мочой
- Определение 25-гидрокси витамина D (по показаниям)
- Паратиреоидного гормона (по показаниям)
- Биохимические маркёры костного метаболизма (таб.2)
Таблица 2. Маркёры костного ремоделирования
|
Костное формирование |
Костная резорбция |
|
|
Исследование биохимических маркеров костного метаболизма не имеет диагностической ценности и в основном преследует две цели:
- Оценить уровень и скорость костного метаболизма (определить тип ОП)
- Оценить эффективность антиостеопоротической терапии
Исследование костных маркеров в динамике на ранних этапах лечения позволяет выделить пациентов «отвечающих» и «не отвечающих» на терапию. Установлено, что снижение маркеров костной резорбции на 50% в первые 3-6 мес указывает на хороший ответ пациентов на лечение. В то время как динамику МПК в ответ на лечение можно заметить не ранее чем через год.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Важным этапом в диагностике ОП является исключение сходных состояний сопровождающихся нарушениями костного метаболизма и переломами (табл.3).
Заболевания, с которыми необходимо дифференцировать остеопороз:
- Остеомаляция
- Костные метастазы
- Первичный гиперпаратиреоз (ПГПТ)
- Болезнь Педжета (костная)
- Миеломная болезнь
Таблица 3. Дифференциально-диагностические признаки (лабораторные) метаболических остеопатий
|
Остеопатии |
Кальций крови |
Кальций мочи |
Фосфор крови |
ПТГ |
25-ОН-D3 |
ОЩФ крови |
|
ПМО |
Н/↑ |
Н/↑ |
Н |
Н/↓ |
Н/↓ |
Н/↑ |
|
ПГПТ |
↑↑ |
↑↑ |
↓↓ |
↑↑ |
↑ |
↑↑ |
|
Остеомаляция
|
Н/↓ |
Н/↓ |
Н/↓ |
Н/↑ |
↓ |
↑ |
|
Костные метастазы |
Н/↑ |
Н/↑ |
Н/↑ |
Н/↓ |
Н/↓ |
↑ |
|
Миеломная болезнь |
Н/↑ |
Н/↑ |
Н/↑ |
Н/↓ |
Н |
↑ |
Примечание: Н - нормальный показатель; ↑ - повышен; ↑↑ - резко повышен; ↓ - понижен
Примеры формулировок диагноза постменопаузального остеопороза.
- Постменопаузальный остеопороз без переломов с преимущественной потерей массы кости в позвонках (Т-критерий -2,8).Дорсалгия (люмбалгия) хронического течения, ФН 1.
- Сенильный остеопороз, тяжелая форма с компрессионным переломом тела Тh12- позвонка, переломом шейки бедра в анамнезе, Т-критерий -3,5, прогрессирующее течение.Торакалгия острого течения, ФН 3.
ЛЕЧЕНИЕ
Цель: предупредить прогрессирование ОП и развитие переломов, улучшить качество жизни больных.
Выбор больных, требующих активной терапии, определяется наличием клинических факторов риска (КФР), возрастом больных, предшествующими переломами и значениями МПК по данным DXA.
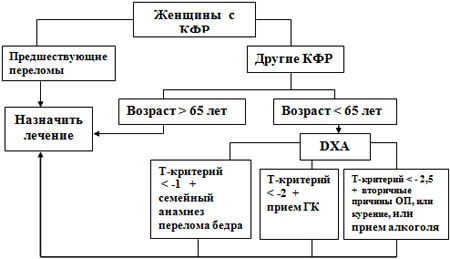
Рис.4. Алгоритм ведения больных с постменопаузальным ОП (адаптировано из Kanis J.A., Adams J., Borgström F. et al., 2008)
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ОСТЕОПОРОЗА
- Достаточное потребление кальция и витамина D c продуктами питания
- Адекватная физическая нагрузка
- Отказ от курения и употребления алкоголя
- Ограниченное употребления кофе ( не более 2 чашек в день)
- Профилактика падений
- Ношение протекторов бедра
- Образовательные программы для пациентов (школы пациентов)
Рекомендуемые продукты питания
- Молочные продукты (твердые сорта сыров, молоко, творог, йогурт, сметана)
- Рыба (вяленая, отварная и т.д.)
- Овощи (сельдерей, салат, оливки, капуста, лук, фасоль)
- Фрукты (курага, инжир, изюм, сушеные яблоки, апельсины)
- Орехи и семена (кунжут, миндаль, арахис, семена подсолнечника и тыквы)
- Ржаной хлеб
- Молочный шоколад
ФАРМАКОТЕРАПИЯ ОСТЕОПОРОЗА
Выбор антиостеопоротического препарата базируется на доказанности его эффективности в предотвращении новых переломов в течение 3-5 лет. К таким препаратам относятся:
- Бисфосфонаты
- Стронция ранелат
- Заместительная гормональная терапия (ЗГТ)
- Селективные модуляторы эстрогенных рецепторов (СМЭР)
- Кальцитонин
- Паратиреоидный гормон (ПТГ)
- Активные матаболиты витамина Д
В зависимости от механизма действия антиостеопоротические препараты могут быть разделены на 3 группы:
|
I. Замедляющие костную резорбцию |
II. Усиливающие костеобразование |
III. Многопланового действия (стимулируют костеобразование и замедляют резорбцию) |
|
бисфосфонаты, кальцитонин, СМЭР, эстрогены |
паратиреоидный гормон, фториды*, анаболические стероиды*, соматотропный гормон* |
активные метаболиты витамина D, стронция ранелат, оссеин-гидроксиапатитный комплекс*, иприфлавон* |
* - отсутствуют доказательства эффективности в предупреждении переломов.
Схемы терапии ОП представлены в таблице 4.
Таблица 4. Схемы терапии остеопороза
|
Препараты |
Дозы и режим назначений |
|
Бисфосфонаты:
|
внутрь по 10 мг 1 р/сут за 30 мин до еды или 70мг 1 раз в нед; по 5 мг ежедневно или 35 мг 1 раз в нед; внутрь по 150 мг (1таб) 1 раз в мес; в/в инфузии 5 мг препарата разведенного в 150 мл физиологического раствора в течение 15 минут 1 раз в год. |
|
Кальцитонин (Миакальцик) |
интраназально по 200 МЕ ежедневно или в/м 100 МЕ через день в течение 2 мес, затем 2-3 мес перерыв. |
|
ЗГТ: Эстрадиол/дидрогестерон Эстрадиол/норэтистерон Тиболон |
внутрь 1 мг/5 мг 1 р/сут е/д внутрь 2 мг/1 мг 1 р/сут е/д внутрь 2,5 мг 1 р/сут е/д |
|
СМЭР: Ралоксифен |
внутрь 60 мг 1 р/сут |
|
ПТГ: Терипаратид |
подкожные инъекции 20 мкг 1 р/сут е/д |
|
Ранелат стронция (Бивалос)
|
По 1 саше растворенному в стакане воды, е/д вечером перед сном, не менее чем через 2 часа после приема пищи |
|
Активные метаболиты витамина D: Альфакальцидол Кальцитриол |
Внутрь по 0,5-1 мкг 1 р/сут Внутрь 0,25 мкг 2 р/сут |
БИСФОСФОНАТЫ (БФ) – лекарственные средства первого ряда в лечении всех видов ОП (ПМО, стероидного и др.). Прием БФ сопровождается клинически значимым снижением риска вертебральных и невертебральных переломов, включая переломы проксимального отдела бедра. Для уменьшения возможных нежелательных явлений со стороны верхних отделов ЖКТ рекомендуется пероральные БФ принимать пациентам только в вертикальном положении и не ложиться в ближайшие часы. Для лучшего усвоения таблетки следует запивать водой (не менее 100 мл), не принимать молочных продуктов, препаратов кальция и железа в течение 1 часа.
КАЛЬЦИТОНИН - препарат второй линии при лечении постменопаузального и ГК- ОП.Имеются доказательства его эффективности в отношении снижения риска переломов позвоночника, но не внепозвоночных переломов.
Основные показания к назначению:
- при неэффективности или плохой переносимости БФ;
- при выраженном болевом синдроме, связанном с остеопоретическими переломами тел позвонков;
- для лечения ГК-остеопороза.
ЗГТ ( монотерапия эстрогенами, комбинированная терапия эстроген-гестагенными препаратами) показана при лечении постменопаузального ОП у женщин с климактерическим синдромом. Множественные системные побочные эффекты значительно ограничивают использование ЗГТ в терапии ОП.
СМЭР (Ралоксифен)является препаратом второй линии для лечения ПМО, так как его эффективность доказана только в отношении предотвращения переломов позвонков. Преимуществами СМЭР перед ЗГТ является отсутствие пролиферативного действия на эндометрий матки и молочные железы. Установлено, что ралоксифен уменьшает риск возникновения эстрогензависимого инвазивного рака молочной железы и рака (или гиперплазии) эндометрия.
Терипаратид рекомендуется использовать:
- для лечения тяжелых форм ПМО ( Т- критерий < -3,0 SD, наличие предшествующих остеопоротических переломов),
- для лечения ОП у мужчин старше 70 лет,
- при неэффективности или плохой переносимости БФ и других препаратов.
Активные метаболиты витамина D – препараты второго рядав лечении первичного (ПМО, сенильного) и ГК - ОП. Не доказана эффективность препаратов в отношении снижения риска перелома шейки бедра. Совместно с препаратами кальция могут использоваться как альтернатива нативному витамину D.
Ранелат стронция (Бивалос) – новый эффективный препарат для лечения ПМО с двойным механизмом действия. Препарат одновременно повышает формирование и уменьшает резорбцию кости.
Препараты кальция (1000-1500 мг/сут) и витамина Д (400-800 МЕ/сут) являются обязательным компонентом любой схемы лечения и профилактики ОП.
При назначении антиостеопоретической терапии помимо определённых показаний не менее важно учитывать возможный спектр побочных эффектов (табл.5).
Таблица 5. Побочные эффекты антиостеопоротической терапии
|
Препараты |
Побочные эффекты |
Комментарий |
|
Бисфосфонаты |
Эзофагит, гастрит, желудка, эрозии и язвы ЖКТ |
Наблюдаются в 14-15% случаев. |
|
Кальцитонин |
Раздражение слизистой оболочки носа, тошнота, рвота, приливы жара к лицу. |
При использовании назального спрея побочные эффекты встречаются в 1,5 раза реже. |
|
ЗГТ (эстрогены и эстроген-гестагенные препараты) |
Повышенный риск тромбоэмболий, рака молочной железы, сердечно-сосудистых заболеваний |
Риск нежелательных явлений возрастает при применении ЗГТ более 3 лет. |
|
СМЭР (Ралоксифен) |
Приливы жара к лицу, судороги в икроножных мышцах, повышение риска венозных тромбоэмболий |
Противопоказан при наличии в анамнезе венозных тромбозов и тромбоэмболий. |
|
ПТГ (Терипаратид) |
Ортостатическая гипотензия, судороги в ногах, тошнота, гиперкальциемия |
Гиперкальциемия обычно наблюдается в первые 6 мес лечения |
|
Кальций |
Метеоризм, запоры, боли в эпигастральной области |
Гиперкальциемии при дозе кальция >2000 мг/cут |
|
Витамин Д3 |
Гиперкальцийурия, гиперкальциемия |
Контроль уровня кальция в крови и моче через 2 и 6 мес от начала терапии. |
Мониторинг терапии. С целью обеспечения безопасности терапии необходимо проведение следующих мероприятий регулярное (1 раз в 3-6 мес) мониторирование следующих показателей:
- биохимический анализ крови - мочевина, креатинин, билирубин, аминотрансферазы, щелочная фосфатаза, общий белок, альбумин, общий и ионизированный кальций)
- коагулограмма (при назначении ЗГТ, СМЭР).
Критерии эффективности антиостеопоретической терапии:
- отсутствие новых переломов костей при минимальной травме;
- стабилизация или прирост МПК через 12-24 мес;
- снижение показателей костной резорбции через 3 – 6 мес терапии.
Эффективность лечения во многом зависит от приверженности пациентов лечению (комплаентности), соблюдения режима приёма препаратов и длительности терапии (не менее 3-х лет). Установлено, что после первого года лечения только 25% больных продолжают принимать назначенные препараты [20]. В связи с чем, особую актуальность приобретают вопросы эффективного взаимодействия врача и пациента, достаточной информированности пациента.
Тактика ведения пациентов с ОП и болью в спине
Основными задачами лечения дорсалгий у больных ОП являются купирование боли, предупреждение дальнейшей потери костной массы и повторных переломов, расширение двигательной активности. Общепринятых стандартов терапии данной группы больных не разработано. Подходы к лечению формируются на основании современных представлений о механизмах болевого синдрома, а также с учетом варианта течения заболевания.
Схема терапии острой дорсалгии при ОП
- Постельный режим (полужесткая поверхность) 1-3 дня
- Холод или легкое сухое тепло
- Ношение корсета (полужесткого) не более 2-х часов в день при нагрузках
- Использование опорных устройств при ходьбе
- НПВП или анальгетики центрального действия:
- Нимесулид 100 мг 2 раза в сутки или
- Мелоксикам 15 мг в\м 1 раз в день - 3 дня, далее per os 7,5-15 мг 1 раз в сутки в течение 10 дней
- Миорелаксанты:
- тизанидин 2-4 мг в сутки -10-14 дней или
- толперизона гидрохлорид 150–450 мг/сут
7. Антиостеопоротическая терапия
Схема терапии хронической дорсалгии при ОП
- ЛФК
- Физиотерапия
- НПВП
- Антиостеопоретическая терапия
- Миорелаксанты
- Хондропротекторы
- Коррекция психологического статуса: антидепрессанты, психотерапия
- Формирование двигательного стереотипа движений (сохранение прямой осанки, исключение сгибания и ротации позвоночника).
ПРОТИВОПОКАЗАНЫ:
- Мануальная терапия
- Паравертебральные блокады с гидрокортизоном
- Силовые высокоинтенсивные упражнения, прыжки, поднятие тяжестей
ПРОФИЛАКТИКА
Первичная профилактика включает:
- выявление лиц с повышенным риском развития ОП;
- адекватное потребление кальция и витамина D во время интенсивного роста (в пре- и пубертатном периоде), беременности и кормлении грудью, а также у женщин в период постменопаузы.
Вторичная профилактика направлена на предупреждение переломов при уже развившемся ОП. С этой целью назначаются антиостеопоротические препараты, препараты кальция и витамина D, проводятся немедикаментозные мероприятия.
У лиц пожилого и старческого возраста особое значение приобретает профилактика падений.
ПРОГНОЗ при своевременной диагностике и лечении ОП благоприятный. Неблагоприятный прогноз обусловлен развитием переломов. Наиболее серьезные последствия связаны с переломом шейки бедра. Общая смертность в течение первого года после перелома бедренной кости составляет 30-35%. Неблагоприятный исход у лиц пожилого и старческого возраста после развития переломов определяется такими осложнениями, как застойная пневмония, тромбозы и эмболии, обострение хронических заболеваний.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ.
- Клинические рекомендации. Остеопороз. Диагностика, профилактика и лечение/ Под ред. О.М.Лесняк, Л.И.Беневоленской.- М.: ГЭОТАР-Медиа, 2010.-272с.
- Насонов Е.Л., Скрипникова И.А., Насонова В.А. Проблема остеопороза в ревматологии. Москва, Стин, 1997,429 с.
- Петак С.М. Денситометрия: интерпретация результатов исследования. Методические указания Международного общества клинической денситометрии. Остеопороз и остеопатии 2004, 2:11-13
- Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ: Рук. для практикующих врачей /Под общ. Ред. И.И. Дедова, Г.А.Мельниченко.-М.:Литтерра, 2006: с.673-687.
- Рожинская Л.Я. Системный остеопороз. М.: Издатель Мокеев, 2000.-196с.
- Руководство по остеопорозу. Под ред. Л.И.Беневоленской.-М.: БИНОМ. Лаборатория знаний, 2003, 524с.
- Bahlous A, Kalai E, Hadj Salah M, et al. Biochemical markers of bone remodeling: recent data of their applications in managing postmenopausal osteoporosis. Tunis Med. 2006; 84(11):751-757.
- Bone Builders: The discoveries behind preventing and treating osteoporosis. Breakthroughs in Bioscience, 2001.
- Francis R. M., Aspray T. J., Hide G. et al. Back pain in osteoporotic vertebral fractures. Osteoporos Int 2008, 19: 895–903
- Haugeberg G, Orstavik RE, Uhlig T et al.Clinical decision rules in rheumatoid arthritis: do they identify patients at high risk for osteoporosis? Testing clinical criteria in a population based cohort of patients with rheumatoid arthritis recruited from the Oslo Rheumatoid Arthritis Register Ann. Rheum. Dis, 2002; 61(12): 1085 – 1089
- Kanis JA, Adams J, Borgström F, Cooper C, Jönsson B, Preedy D et al. The cost-effectiveness of alendronate in the management of osteoporosis. Bone 2008,42(1): 4–15.
- Kanis JA, Burlet N., Cooper C. et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2008,19:399–428
- McCombs JS, Thiebaud P, McLaughlin-Miley C, Shi J. Compliance with drug therapies for the treatment and prevention of osteoporosis. Maturitas. 2004,15;48:271-287.
- National Osteoporosis Foundation. Physician's Guide to Prevention and Treatment of Osteoporosis. Washington DC: National Osteoporosis Foundation; 2003.
- Raisz L.G.Pathogenesis of osteoporosis: concepts, conflicts, and prospects. J Clin Invest. 2005; 115(12): 3318–3325.
- World Health Organization. Assessment of osteoporosis at the primary health care level. Summary Report of a WHO Scientific Group. WHO, Geneva, 2007
