- 🚛 В наличии на складе
-
COVID-19
- Средства индивидуальной защиты
- Кабина дезинфекции
- Ультрафиолетовый облучатель
- Термометр медицинский
- Измеритель АД
- Аппараты ИВЛ
- Увлажнитель кислорода
- Монитор пациента
- Шприцевой насос
- Аспиратор электрический
- Анализатор газов в крови
- Спирометр Пульсоксиметр
- Реабилитация лёгочной дисфункции пациентов, перенёсших Covid-19.
- Аппараты НИВЛ
- Диагностика
- Физиотерапия
- Криотерапия
- Контрпульсация (УНКП)
- Литотриптеры
-
Тепло и грязелечение
- Автоматизированные кухни для Теплолечения
- Система с подогревом для релаксации и грязевых аппликаций Aqua-Relax
- Система для релаксации с нагретым песком Sand Relax
- Инфракрасный теплоизлучатель Theramed 4
- Автоматизированные кухни для Грязелечения
- Мини−кухни для Применения Пакетированных Грязевых Аппликаций
- Системы для Обертываний «Velvet»
- Система пелоидотерапии конечностей
- Одноразовые грязевые аппликации
- Косметология
- Активное долголетие
- Хирургия
- Ветеринария
-
Реабилитация
- Тренажер с универсальной нагрузкой EN-Tree Pulley MDD
- Подвес реабилитационный «Орторент М»
- Аппарат для механотерапии «ОРТОРЕНТ» модель «Актив»
- Аппарат двигательный «Орторент-лучезапястный»
- Тренажер «Орторент Carmina»
- Электростимулятор Cefar Rehab X2
- Система электротерапии VitalStimPlus
- Беговая дорожка детская с БОС «Орторент»
Усиленная наружная контрпульсация ограничивает гиперплазию интимы посредством модификации экспрессии стресс-чувствительного гена напряжения сдвига у геперхолестеринемических свиней
Yan Zhang, Xiaohong He, Xiaolin Chen, Hong Ma, Donghong Liu, Jinyun Luo, Zhimin Du, Yafei Jin, Yan Xiong, Jiangui He, Dianqiu Fang, Kuijian Wang, William E. Lawson, John C.K. Hui, Zhensheng Zheng and Guifu Wu
Circulation published online Jul 9, 2007;
Резюме
Предпосылки – усиленная наружная контрпульсация (УНКП) – это аппарат вспомогательного кровообращения, который может, увеличивая напряжение сдвига улучшить эндотелиальную дисфункцию. Хронической воздействие относительно высокого физиологического напряжения сдвига на эндотелиальные клетки и гладкомышечные клетки сосудов оказывает антипролиферативное и вазопротективное действие. Настоящее исследование выдвигает следующую гипотезу: УНКП тормозит гиперплазию интимы и развитие атеросклероза через модификацию экспрессии стрессочувствительного гена напряжения сдвига.
Методы и результаты – 35 свиней мужского пола рандомизированы в 3 группы: диета с высоким содержанием холестерина (n=11), диета с высоким содержанием холестерина плюс УНКП (n=17) и обычная диета (контрольная группа; n=7). Коронарные артерии, аорта животных подверглись гистопатологическому, иммуногистохимическому исследованию, а также Вестерн блот анализу. Пик диастолического напряжения сдвига артерии значительно увеличивался во время УНКП по сравнению с исходным состоянием (49,62±10,71 против 23,92±7,28 дин-см2; p<0,001). Гиперплазия интимы наблюдалась в коронарных артериях группы с диетой с высоким содержанием холестерина, тогда как у животных, получающих УНКП, соотношение площади интимы-медиа значимо снизилось на 41,59% (21,27±10,00% против 36,41±16,69%; p=0,008). Гиперхолестеринемия уменьшала экспрессию эндотелиальной NO синтазы и увеличивала фосфорилирование внеклеточной сигнал-регулируемой киназы 1/2. УНКП терапия смягчала эти неблагоприятные изменения.
Заключение – УНКП снижает гиперхолестерин-индуцированное повреждения эндотелия, тормозит пролиферацию и миграцию клеток гладкомышечных клеток сосудов, уменьшает индекс ядерного антигена клеточной пролиферации, подавляет формирование внеклеточного матрикса и в конце концов тормозит избыточный рост интимы и развитие атеросклероза увеличивая напряжение сдвига на стенки артерии, что в свою очередь активизирует эндотелиальную NO синтазу/метаболическую NO и возможно подавляет чрезмерную активацию внеклеточной сигналрегулируемой киназы 1/2. (Circulation. 2007; 116:&NA;-.)
Ключевые слова: атеросклероз ■ эндотелий ■ гиперхолестеринемия ■ синтез оксида азота ■ ремоделирование
Введение
В настоящее время признано, что гемодинамические воздействия регулируют многочисленные функции клеток в сердечно-сосудистой системе. Клетки сосудистого эндотелия (VECs) постоянно подвергаются и чувствительны к напряжению сдвига, вызываемому током крови. Напряжение сдвига модулирует структуру и функцию эндотелиальных клеток. Оно также является одним из основных факторов определяющих тонус артерий, ремоделирование сосудов и развития атеросклероза.1 Было показано, что атеросклеротическое повреждение развивается преимущественно в определенных местах, таких как бифуркации или места отхождения ветвей - местах турбулентного кровотока или с низким напряжением сдвига2. С другой стороны, ламинарный поток, вызывающий физиологическое высокое напряжение сдвига, может определять противовоспалительные, антитромботические и антипролиферативные свойства.
Клиническая перспектива
Усиленная наружная контрпульсация – неинвазивный способ лечения лечения больных коронарной болезнью сердца, особенно, для тех больных, которые не подходят для процедур реваскуляризации или рефрактерны к стандартной фармакотерапии. УНКП уменьшает симптомы стенокардии и увеличивает переносимость физических нагрузок у большинства пациентов, прошедших лечение4-5. Растущее количество данных подтверждают идею, что улучшение функции эндотелия представляет важный механизм реализации клинического эффекта УНКП6-7. Однако раскрытие точного молекулярного механизма влияния остается труднодостижимо, нет данных по моделям животных с атеросклерозом, кроме как срочного применения УНКП.
Настоящее исследование было спланировано для изучения влияния УНКП на функцию сосудистого эндотелия, ремоделирование сосудов и атерогенез, а также для изучения экспрессии VEC генов в экспериментальной модели гиперхолестеринемии у свиней. Мы предположили, что УНКП может увеличить напряжение сдвига в организме (in vivo), улучшить структуру и функцию сосудистого эндотелия, ингибировать гиперплазию интимы, и в результате, приостановить атерогенез посредством модуляции экспрессии стрессчувствительного гена напряжения сдвига через активирование экспрессии эндотелиальной NO синтазы (eNOS) и, возможно, подавления внеклеточной активности сигнал-регулируемой ½ киназы (ERK1/2).
Методы
Экспериментальная модель
35 Йоркширских самцов и Лендренских самок первого поколения свиней (Свиной комплекс Южного китайского университета, г. Гуанчжоу, Китай) весом в среднем 7,4 кг были случайно распределены на 3 группы (7,6±0,7 кг контрольная группа; 7,2±0,8 кг диета с высоким содержанием холестерина[CHOL]; 7,4±0,8 кг диета с высоким содержанием холестерина плюс УНКП [CHOL+EECP]). Все процедуры проводились в соответствии с Инструкцией по уходу и использованию лабораторных животных, опубликованной Национальным институтом здравоохранения США. 7 свиней кормили традиционным образом (контрольная группа) в течение 15 недель. 28 свиней были на атерогенной диете с высоким содержанием холестерина: 4% холестерина, 10% яичного порошка, 8% сала и 1,2% соли в течение 15 недель. Через 8 недель диеты с высоким содержанием холестерина, и продолжением нахождения на атерогенной диете, 17 гиперхолестеринемических свиней подверглись УНКП (группа [CHOL+EECP]). Остальные 11 свиней послужили гиперхолестеринемическим контролем (группа [CHOL]). Все свиньи были анестезированы 5-10 мг мидозалама внутримышечной инъекцией и в/в инфузией 3%-го раствора пентобарбитала 10 мг/кг в час. Пробы крови были собраны исходно и на 8-й, 12-й и 15-й неделе исследования для определения липидных профиля (Хитачи 7170А Токио, Япония) и вязкости крови (Rheocalc V2.1 Brookfield Engineering Laboratory, Inc, Middle-boro, Mass). На 15-й неделе выполнена эвтаназия токсической дозой 10%-го раствора хлорида калия, введенной в сердце.
Протокол УНКП
Свиньи группы [CHOL+EECP] в целом получили 34±2 часа УНКП, 2-часовые сеансы раз в два дня в течение семинедельного периода, что соответствует стандартному протоколу клинической УНКП. С использованием клинической системы (Shuangshan EECP-MCI, г. Гуанчжоу, Китай) УНКП проводилась после того, как свиней клали на левый бок и надевали два набора манжет, которые фиксировали нижние конечности и бедра свиньи. Манжеты последовательно накачивали воздухом в направлении, от дистальных к проксимальным, в раннюю диастолу и быстро сдувались прямо перед систолой. Давление в манжетах составляло от 0,035 до 0,040 мПа/см². Эффективные гемодинамические изменения УНКП были продемонстрированы достижением отношением диастола-систола>1,2 при использовании плетизмографии.
Гемодинамические измерения
На 15-й неделе выполняли допплерографию кровотока с использованием ультразвуковой системы (ATL-HDI-5000, Phillip Com America) оснащенной ЭКГ контролем и 5-10 МГц мультичастотным линейным ультразвуковым датчиком с высокой разрешающей способностью, как было описано раннее8. Для вычисления напряжения сдвига, внутреннего диаметра и скорости кровотока в правой плечевой артерии исследования выполнены до УНКП и во время ее проведения. Максимальную диастолическую скорость регистрировали как среднюю трех сердечных циклов.
Величина напряжения сдвига на стенке сосуда (τ) была рассчитана в соответствии с формулой9 τ (дин/см²)=4ηV/ID, где η – это вязкость, выраженная в пуаз, V – скорость кровотока, выраженная см/сек, а ID – это внутренний диаметр, выраженный в сантиметрах.
Морфологический анализ
В конце эксперимента сегмент 1 см левой передней нисходящей венечной артерии (LAD), дистальнее на 0,5 см от бифуркации ствола левой коронарной артерии, был собран, зафиксирован, а затем разделен на три сегмента: проксимальный, средний и дистальный. Сегменты, залитые парафином, были разделены на поперечные срезы толщиной 4 μm и окрашены гематоксилиномэозином или альдегидом фуксином Гомори. Параметры были измерены в масштабе ×40 с использованием Системы автоматического анализа изображений Zeiss-KONTRON IBAS 2.5 (Зеис, Мюнхен, Германия). Для оценки ремоделирования сосудов были рассчитаны интимо-медиальное отношение, и отношение стенка- просвет сосуда. Чтобы измерить отложение коллагена в стенках коронарной артерии, были просканированы секции, обработанные Gieson, чтобы определить процентное отношение интимальной области и частично медиальной области, занятой коллагеном. Для каждой левой передней нисходящей венечной артерии (LAD) было проанализировано, по крайней мере, 3 секции различных сегментов. Сегменты LAD были обработаны для растровой электронной микроскопии (Hitachi S520). Морфологический анализ, Western blot денситометрия и иммуногистохимический анализ были проведены лаборантами, которые ничего не знали о критериях разделения групп.
Иммуногистохимическое исследование
Серийные, залитые парафином поперечные срезы левой передней нисходящей венечной артерии (LAD) использовались для иммунного окрашивания в соответствии со стрептавидинбиотиновым комплексом или иммуногистохимическим методом Elivision10. Срезы инкубировались с поликлональными фосфо-ERK антителами кролика (в разведении 1:100; Сell Signaling Technology, Danvers, Mass), с поликлональными антителами eNOS (при растворе 1:70; Биотехнология Santa Cruz, Inc, Santa Cruz, Calif), с антителами анти-пролиферирующего ядерного антигена клеток (PCNA) мышей (в разведении 1:100; Dako, Glostrup, Denmark) или с моноклональными гладкомышечными α-актиновыми антителами мышей (в разведении 1:100; Boster Biological Technology, Inc, Wuhan, China). Индекс пролиферации был определен как процентное соотношение PCNA-положительного числа клеток против общего числа клеток, содержащих ядро. Определяли процентное отношение площади интимы к площади α-актинпозитивной интимы. Контроль в случае
отсутствия антител также был выполнен.
Western blot –анализ
Дуга аорты была мгновенно заморожена и гомогенизирована в реагенте экстрагирования тканевого белка (T-PER)(Pierce Chemical Co, Rockford, Ill) при 00С-40С. Концентрация белка определена системой белкового спектра соответственно производителю (Bio-Rad Dc; Bio-Rad Laboratories, Hercules, Calif). Равные количества общего белка, 30 μg каждое, подверглись электрофорезу в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) с использованием 6% геля для eNOS и 10% геля для фосфо-ERK1/2. Отделившийся белок был перенесен электрофорезом в HybondPVDF (ПВДФ) мембраны (Amersham Pharmacia Bio). После блокировки мембраны инкубировались с eNOS антителами (в разведении 1:200) в течение ночи или антителами фосфо-ERK1/2 (в разведении 1:1000; набор фосфоПлюс, клеточная сигнализация) при 30 V и 40С, затем они инкубировались с вторичным конъюгированным антителом пероксидазы из хрена (1:2000) и подвергались рентгенограмме с использованием улучшенной хемилюминесцентной иммуноблотинговой системы обнаружения. Количество белка было определено денситометрией.
Затем, мембраны были отслоены в стриппинг-буфере (100 mmol/L β-ME, 2% SDS, 62.5 mmol/L Tris-HCI, pH 6.8) при 480С на 30 мин, затем были заблокированы, инкубированы с общим числом антител ERK1/2 (подобно варианту, описанному выше, при растворе 1:1000) и определены как внутренний контроль.
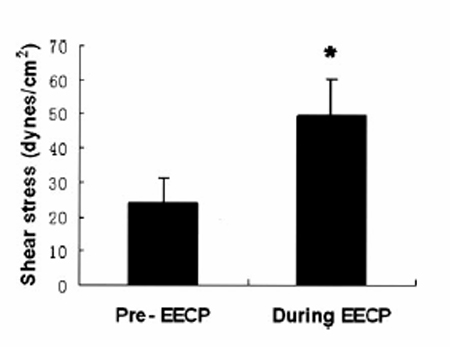
Рис.1 Влияние УНКП на напряжение сдвига правой плечевой артерии свиньи. УНКП значительно увеличила пиковое диастолическое напряжение сдвига. Данные представлены как средняя ± стандартное отклонение 13 свиней группы CHOL+EECP. *P<0.05, исходно против во время EECP.
Статистический анализ
Данные представлены как среднее±SD, пока не высветится обратное. Когда однородность дисперсии была подтверждена тестом однородности дисперсии Levene, статистическое сравнение трех групп было осуществлено однофакторным дисперсионным анализом (ANOVA). Если результаты F-теста были < 0,05, то вторичное сравнение осуществлялось с поправкой Бонферрони. Значение p<0,05 рассматривалось как статистически значимое. В случае неправильного распределения в качестве альтернативы использовали критерий ранжирования Крускала-Уоллиса, с p<0,05 выражающим значимое различие. Вторичные сравнения осуществлялись с помощью теста МаннаУитни для двух независимых образцов, записывая точную двустороннюю значимость. Для исключения ошибок из-за множественных сравнений, уровни значимости уточнялись методом Хольма. Это использовалось, например, в результатах, представленных на pис.5: p<0,017 рассматривалось как статистически значимое для сравнения группы на диете с высоким содержанием холестерина [CHOL] против контрольной группы, p<0,025 для группы [CHOL] против группы с диетой с высоким содержанием холестерина плюс УНКП [CHOL+EECP], и p<0,005 для контрольной группы против группы [CHOL+EECP].
В случае многократных повторных измерений (измерения уровня холестерина и липопротеина низкой плотности), выполняли анализ повторных измерений с основными линейными моделями полного однофакторного дисперсионного анализа (ANOVA), за которым следовали вышеупомянутые методы. Для всех статистических расчетов использовалось программное обеспечение SPSS 13.0.
Авторы имеют полный доступ к данным и несут ответственность за их целостность. Все авторы ознакомлены и согласны с рукописью.
Результаты
Характеристика группы свиней диеты с высоким содержанием холестерина плюс УНКП В конце исследования на 15-й неделе масса тела группы с диетой с высоким содержанием холестерина плюс УНКП [CHOL+EECP] был немного, но не значимо ниже веса группы свиней на диете с высоким содержанием холестерина [CHOL] без УНКП (p<0,05) (Таблица). Результатом атерогенной диеты стало 4,79 –кратное увеличение уровня сывороточного холестерина и 6,66 кратное увеличение уровня липопротеина низкой плотности в группе [CHOL]. Уровни холестерина группы CHOL+EECP были немного ниже, чем у группы [CHOL], но не значимо (p>0,05).
Гемодинамический эффект УНКП
На 15-й неделе вязкость крови в группе CHOL+EECP составила 3,8±0,4 мПа (0,038±0,004 пуаз). Максимальная скорость кровотока, зафиксированная в диастолу в правой плечевой артерии допплерографически во время УНКП, была значительно выше, чем до УНКП (24,62±4,74 против 59,48±13,60; p<0,001). Внутренний диаметр правой плечевой артерии значимо не изменился во время УНКП (1,65±0,42 против 1,68±0,44мм; p<0,05). Максимальное диастолическое напряжение сдвига на артерии во время УНКП возросло в два раза по сравнению с исходом (23,92±7,28 против 49,62±10,71 дин/см³; p<0,001), как показано на pис 1.
Характеристика групп и морфологический анализ левой передней нисходящей венечной артерии свиней на 15-й неделе
| Характеристики |
Контроль (n=7) | СHOL (n=11) | СHOL + УНКП (n=17) |
| вес тела, кг |
71,50±4,80 | 72,71±6,35 | 70,38±2,32 |
| холестерин, ммоль/л |
1,88±0,32 | 9,01±2,89* | 6,98±2,85* |
| липопротеин низкой плотности, ммоль/л |
0,91±0,27 | 6,06±2,47* | 4,72±2,57* |
| доля гладкомышечной клетки, % |
15,13±13,84 | 53,11±16,61* | 24,54±17,45† |
| индекс ядерного антигена пролиферирующих клеток, % |
42,01±18,65 | 75,07±12,47* | 51,72±12,62† |
| доля коллагена, % |
12,35±6,85 | 26,55±10,05* | 12,03±2,94† |
| область интимы, 0³ μм² |
11,58±5,67 | 28,72±14,25* | 13,61±6,84† |
| медиальная область, ×10³ μм² |
59,38±14,56 | 73,92±11,29 | 65,28±11,64 |
| отношение площади интима-медиа, область, % |
19,70±9,01 | 36,41±16,69 | 21,27±10,00† |
| диаметр просвета, μм |
355,43±123,47 | 339,50±42,88 | 355,42±44,87 |
| толщина стенок, μм |
55,62±6,79 | 77,84±11,15* | 60,39±10,75† |
| отношение толщина стенки-просвет, % |
18,04±8,23 | 23,95±4,44 | 17,57±4,70 |
Значение среднее ±SD (стандартное отклонение)
* p<0,01 по сравнению с контрольной группой
† p<0,01 по сравнению с группой [CHOL]
Морфологические исследования
Электронный микроскопический анализ
Поверхность просвета коронарных артерий CHOL группы была покрыта значительным количеством адгезированных клеток, а эндотелиальные клетки сосудов были также беспорядочно выстроены и заметно слущены, представляя значимое повреждение эндотелия (рис. 2 B). Напротив, в группе CHOL+EECP наблюдалось меньше клеточной адгезии и меньше десквамированных эндотелиальных клеток, кроме того, отмечена тенденция того, что VECs стремились выстраиваться параллельно направлению току крови, как показано на рис. 2 C.
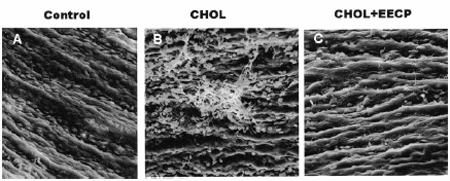
Рис. 2 Электронная микроскопия левых передних нисходящих венечных артерий свиней (увеличение ×500). А –микроснимок контрольной группы. В - микроснимок группы CHOL. Поверхность просвета покрыта значительным количеством адгезированных клеток; наблюдался серьезный эндотелиальный беспорядок клеток и их слущивание. С - микроснимок группы CHOL+EECP.
Наблюдается меньшее количество адгезированных клеток. Эндотелиальные клетки сосудов, выстраиваются параллельно току крови.
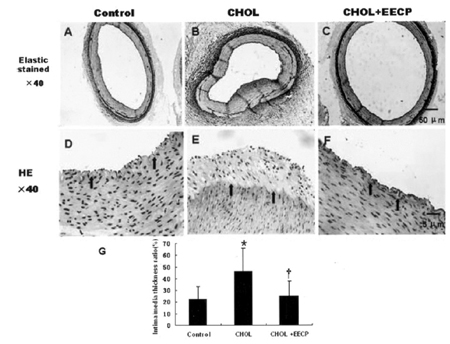
Рис.3 Влияние УНКП на гистоморфологию и гиперплазию интимы левых передних нисходящих венечных артерий (LAD) гиперхолестеринемических свиней. А, В и С – микрофотоснимки (увеличение ×40) гибких окрашенных LAD (темно-фиолетовый). D, E и F – наглядные микрофотоснимки (увеличение×400) срезов LAD, окрашенных гематоксилином-эозином (HE). A и D – контрольная группа. В и E – группа [CHOL]. C и F – группа [CHOL+EECP]. G – влияние УНКП на отношение толщины интимы-медиа левых передних нисходящих венечных артерий свиней (LAD). Значимое утолщение интимы наблюдается в группе [CHOL]. Результатом УНКП является уменьшение гиперплазии интимы в группе [CHOL+EECP]. Стрелками показана внешняя эластичная пластинка. Данные представлены в виде среднее ± SD (допустимое отклонение). * р=0,007<0,05; † р=0,002<0,05 против группы [CHOL], однофакторный дисперсионный анализ (ANOVA) и тест Бонферрони.
Гиперплазия интимы
В левых передних нисходящих венечных артериях (LAD) группы CHOL ярко выражено утолщение интимы и значимое атеросклеротическое повреждение, как показано на рис. 3В и 3Е. Морфометрический анализ выявил, что площадь интимы (р=0,004<0,025 против контрольной группы) и толщина стенок (р=0,001 против контрольной группы) были значительно больше у группы [CHOL], чем у нормальной контрольной группы, как показано в таблице. У свиней группы [CHOL+EECP] площадь интимы была значительно меньше (р=0,001<0,017 против группы [CHOL]) и толщина стенок артерий была значительно тоньше (P=0,001<0,05 против группы [CHOL]), чем в группе [CHOL], как показано на рис. 3С и 3F. Тем временем различия площади медии, ее толщины и площади внутренней эластической пластинки среди трех групп не достигли статистической значимости (р≥0,05). УНКП привела значимому снижению отношения интимамедиа (р=0,008<0,017 против группы [CHOL]) и отношения стенка-просвет сосуда (р=0,004<0,05 против группы [CHOL]), показывая тем самым антигиперпластический эффект (Таблица).
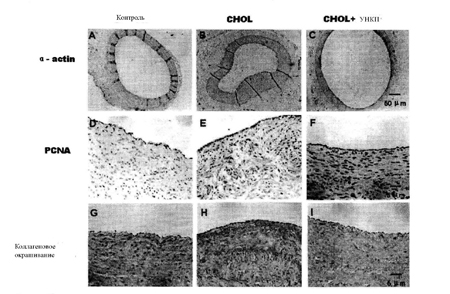
Рис.4 Влияние УНКП на ремоделирование сосудов у гиперхолестеринемических свиней. A, B и C – наглядные микрофотоснимки гладкой мускулатуры – характерное α-актиниммуногистохимическое окрашивание левых передних нисходящих венечных артерий (LAD) (коричневый, увеличение×40). В группе [CHOL] гладкомышечные клетки сосудов (VSMCs) пролиферировали и мигрировали из средней оболочки в интиму. В группе [CHOL+EECP] меньшая толщина интимы сопровождалась меньшим количеством VSMCs в интиме. D, E и F – Иммуноги-стохимическое окрашивание против PCNA левых передних нисходящих венечных артерий (LAD) (коричневый, увеличение×400). A, D и G – контрольная группа. В, E и H – группа [CHOL]. C, F и I – группа [CHOL+EECP]. Наблюдался выраженный рост числа PCNA-положительных клеток в группе [CHOL]. У животных после УНКП пролиферативные изменения приостанавливались в значительной степени. G, H и I – V-G коллагеновое окрашивание LAD (красный, увеличение×400). Значительное накопление коллагена наблюдалось в группе [CHOL], но оно было приостановлено УНКП.
Пролиферация гладкомышечных клеток сосудов
У гиперхолестеринемических свиней гладкомышечные клетки сосудов (VSNCs) пролиферировали и мигрировали из средней оболочки в интиму через поврежденную и дезорганизованную эластическую мембрану (рис 4В). Объем фракции гладкомышечных клеток сосудов (VSNCs), как показано процентным соотношением площади интимы, занятой гладкомышечными клетками в интиме11, значимо увеличился в группе [CHOL], в сравнении с контрольной группой (р=0,005<0,05), как показано в таблице. УНКП уменьшило долю гладкомышечных клеток на 53,79% по сравнению с группой [CHOL] (р=0,003<0,05). Эти результаты показывают, что уменьшение толщины интимы LAD свиней группы [CHOL+EECP] сопровождалась уменьшением количества гладкомышечных клеток сосудов (VSNCs) в интиме (рис 4С).
Коэффициент пролиферации
Как показано на рис. 4, PCNA-положительные клетки (в основном VECs и VSMCs) были обнаружены в интиме и в средней оболочке LAD. PCNA-положительный коэффициент был значительно выше в коронарных артериях группы [CHOL], чем у контрольной группы (р<0,001 против контрольной группы), как показано на рис. 4 Е и в таблице. Уменьшенное число PCNA-положительных клеток в коронарных артериях группы [CHOL+EECP] (р=0,005<0,025 против группы [CHOL]) показывало, что пролиферативные изменения, вызванные гиперхолестеринемией, были в значительной степени восстановлены вмешательством УНКП (Рис. 4F).
Ремоделирование коллагена
В гиперплазированной интиме LAD наблюдалось истончение и разрывы внутренней эластичной мембраны, и пролиферация эластичного фибрина, и его дезорганизация (рис 3В). Также было отмечено значительное отложение коллагена в гиперплазированной интиме и частично в средней оболочке (р=0,001<0,025 против контрольной группы) (рис. 4H). Процентное соотношение коллаген-положительной области в группе [CHOL+EECP] было значительно ниже, чем в группе [CHOL] (P<0,001). Данные результаты показывают, что пролиферация соединительной ткани сосудов и внеклеклеточной матрицы, вызванная гиперхолестеринемией, была приостановлена УНКП, как показано в таблице и на рис. 4I.
Влияние УНКП на уровень экспрессии протеина eNOS
Микроснимки LAD свиней с иммуногистохимическим окрашиванием антител eNOS показаны на рис.5. Протеин eNOS локализировался в основном в VECs (эндотелиальных клетках сосудов). В группе [CHOL] наблюдалось более слабая экспрессия eNOS (рис. 5В). В группе [CHOL+EECP] снижение экспрессии eNOS было незначительным (рис. 5С).
Western блоттинг показал, что количество eNOS протеина было значительно снижено в группе [CHOL], по сравнению с контрольной группой (р=0,009<0,017). Уровень eNOS протеина в группе [CHOL+EECP] был в 3,16 выше, чем в группе [CHOL] (р=0,023<0,025 против группы [CHOL]). Данные результаты предполагают, что УНКП значительно увеличивает экспрессию протеина eNOS и ослабляет выраженное ингибирование экспрессии eNOS, вызванное гиперхолестеринемией. Изменения, наблюдавшиеся в Western блоте, согласовывались с результатами иммуногистохимии.
Влияние УНКП на активность фосфо-ERK1
Как показано иммуногистохимическим окрашиванием с фосфо- ERK1/2 на рис.6, фосфорилированный (активированный) ERK1/2, определенное по коричневому окрашиванию, был обнаружен в основном в ядрах VECs и в гладкомышечных клетках. В местах атеросклеротического повреждения фосфо- ERK1/2 протеин был в изобилии в гиперплазированной интиме (Рис. 6В). Пположительно-окрашенных ядер не наблюдалось в интиме группы [CHOL+EECP].
Как показано Western блот анализом, активность ERK1/2 (выраженная как отношение фосфо-ERK1/2 к общему ERK1/2) была выше в группе [CHOL] (р=0,035<0,017 для ERK1 и р<0,001 для ERK2 против контрольной группы). В группе [CHOL+EECP] активность ERK1/2 показала тенденцию к снижению (р=0,036<0,025 для ERK1 и р=0,026<0,025 для ERK2 против группы [CHOL]), как показано на рис. 6Е. Данные результаты показывают, что вмешательство УНКП значительно приостановило фосфорилирование ERK1/2, вызванное гиперхолестеринемией. Изменения, наблюдавшиеся в западном блоте, также согласовывались с результатами иммуногистохимии.
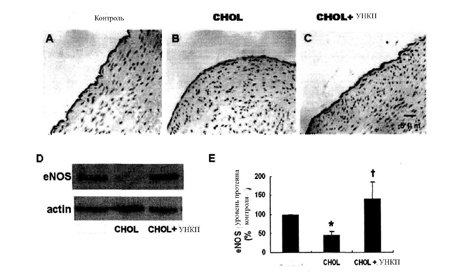
Рис. 5 Влияние УНКП на экспрессию протеина eNOS. A, B и C – иммуногистохимия (увеличение×400) eNOS в LAD трех групп (VECs, окрашенные коричневым). Экспрессия протеина eNOS была значимо снижена в группе [CHOL], но в группе [CHOL+EECP] она была в значительной степени восстановлена. А – контрольная группа. В - группа [CHOL]. С – группа [CHOL+EECP]. D –наглядные Western блот полосы eNOS в аортах свиней. Полосы актина служили в качестве контроля для равного заполнения протеином. Е – гистограммы, показывающие интенсивность флюоресценции полос, выраженной коэффициентом контроля. Результаты представлены, как среднее ±SEM пяти независимых экспериментов из 27 образцов протеина свиней. Экспрессия протеина eNOS была ингибирована в группе [CHOL] и увеличена в группе [CHOL+EECP]. * р=0,009<0,017, группа [CHOL] против контрольной группы; † р=0,023<0,025 группа [CHOL+EECP] против группы [CHOL], тест Манн-Уитни и метод Хольма.
Обсуждение
Напряжение сдвига вероятно наиболее важный локальный фактор, способный влиять на атерогенез. В крупных артериях значение напряжения сдвига находится в диапазоне от 10 до 70 дина/см². Уровень артериального напряжения сдвига (>15 дина/см²) вызывает эндотелиальный покой и атеропротективный профиль экспрессии гена, тогда как низкое напряжение сдвига (<4 дина/см²), превалирующее в областях, предрасположенных атеросклерозу, стимулирует атерогенный фенотип. Напряжение сдвига регулирует структуру и функцию эндотелиалия путем регуляции экспрессии механочувствительных генов. VECs, подверженные длительному ламинарному напряжению сдвига на относительно высоком уровне имеют более низкую скорость синтеза ДНК, чем в условиях статического состояния12. У животных с сосудистыми шунтами13 или со стентированными сосудами14, повышенное локальное напряжение сдвига вызывает регрессию гиперплазии интимы.
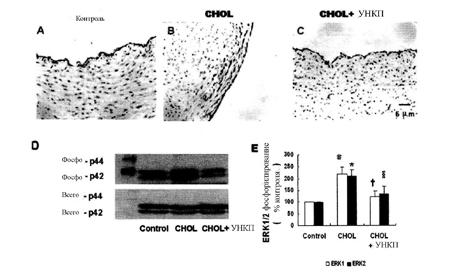
Рис.6 Влияние УНКП на активацию ERK1/2, вызванную гиперхолестеринемией. А, В и С –микрофотоснимки (увеличение×400) иммуногистохимического окрашивания против ERK1/2 (коричневое окрашивание, ядро локализировано) LAD свиней. Экспрессия фосфо-ERK1/2 значительно увеличилась в группе [CHOL], но приостановилась в группе [CHOL+EECP]. А – контрольная группа. В - группа [CHOL]. С – группа [CHOL+EECP]. D – наглядные западные блот ленты фосфо-ERK1/2 и общее ERK1/2 (после отслаивания) аорты свиньи. Е - гистограммы, показывающие интенсивность флюоресценции бэндов/лент, выраженной как отношение фосфо/общее ERK1/2. Фосфорилирование ERK1/2, вызванное гиперхолестеринемией, было приостановлено в группе [CHOL+EECP]. Результаты выражены, как среднее ±SEM шести независимых экспериментов из 32 образцов протеина свиней. #P=0,035<0,017 для ERK1 группы [CHOL] против контрольной группы;
*р=0,001<0,017 для ERK2 группы
[CHOL] против контрольной группы;
†р=0,036<0,025 для ERK1 группы [CHOL+EECP] против группы [CHOL];
§р=0,026<0,025 для ERK2 группы [CHOL+EECP] против группы [CHOL];
тест Манн-Уитни и метод Хольма.
Было продемонстрировано, что у человека возрастание напряжения сдвига тормозит гиперплазию неоинтимы после имплантации стента15,16.
Последовательное систолическое спускание/диастолическое надувание манжет во время УНКП приводит к систолической разгрузке и диастолической аугментации, результатом чего является увеличение кровотока пульсирующим образом. В настоящем исследовании данные показали, что во время УНКП максимальное диастолическое артериальное напряжение сдвига на стенки сосуда возросло в 2 раза. УНКП определенно повышает напряжения сдвига артериальных стенок в организме, тогда как большинство лекарств не смогли продемонстрировать такой благоприятный гемодинамический эффект.
Используя гистопатологические и морфологические исследования, мы на примере свиней показали очевидность того, что УНКП уменьшает повреждения эндотелия, вызванные гиперхолестеринемией, останавливает ремоделирование коллагена и тормозит пролиферацию и миграцию гладкомышечных клеток сосудов (VSNCs), эти результаты подтверждаются снижением клеточного пролиферативного индекса. Значительное влияние УНКП на эти основные компоненты атеросклеротического повреждения обеспечивает поддержку гипотезы о том, что УНКП может ограничивать гиперплазию интимы, вызванную гиперхолестеринемией.
Острый рост касательного напряжения может вызвать активное образование NO, которое играет решающую роль в расслаблении сосудов, тогда как хроническое образование NO из-за повышенного напряжения сдвига может служить в качестве антиатерогенной и антивоспалительной молекулы17. Будучи основным, лимитирующим скорость образования NO, NO синтаза, восприимчивая напряжению сдвига через промоторную область гена, NO синтаза может быть механосенсором, обусловливающим высвобождение NO с долгосрочными гемодинамическими изменениями18. Предыдущие исследования показали, что первичный дефект синтеза NO может ускорять образование неоинтимы и ослаблять эндотелиальную функцию. Напротив, стратегии, направленные на увеличение локального образования NO, такие как перенос eNOS генов20 или доставка донора NO21, тормозит утолщение неоинтимы после повреждения артерии. Как клиническое исследование, так и опыты на животных в нашей лаборатории показали, что УНКП увеличила уровень плазмы NO и экспрессию генов eNOS22,23. В настоящем исследовании наши результаты показывают, что гиперхолестеринемия значительно снизила уровень протеина eNOS, тогда как УНКП значительно увеличила экспрессию протеина eNOS.
Широко известно, что регулярные физические упражнения улучшают эндотелиальную функцию за счет повышения кровообращения и напряжения сдвига, что в свою очередь увеличивает eNOS/NO метаболизм24. В данном аспекте механизм УНКП подобен физическим упражнениям. Так как большинство кардиологических пациентов не могут делать физические упражнения в достаточной мере для того, чтобы достигнуть подобного уровня увеличения артериального напряжения сдвига, то УНКП может помочь обеспечить защиту сосудов, подобную интенсивным физическим упражнениям.
Торможение фосфорилирования ERK1/2 оказалось критическим в торможении NO ингибированной клеточной пролиферации25. Оказалось, что пероксинитрит и супероксид NO, вызванные напряжением сдвига, действуют как сигнальные молекулы в зависимой от потока активации митоген-активируемой протеинкиназы. Предыдущее исследование документально доказало, что экзогенный NO посредничает с временной градиентной активацией, вызванной сдвигом, и с постоянной отрицательной негативной модуляцией фосфо-ERK1/2, вызванной сдвигом26. С другой стороны, NOS блокада стимулирует синтез протеина расширением фосфорилирования ERK1/2 в крупных артериях25. Как центральный элемент ростового сигнального пути, ERK1/2 напрямую вовлекается в перенос сигналов из рецепторов фактора роста в ядро, чтобы регулировать транскрипцию генов и синтез протеина, что приводит к пролиферации, дифференциации или апоптозу. В настоящем исследовании фосфорилирование ERK1/2 было активировано в контрольной группе гипохолестеринемических свиней, тогда как в группе УНКП оно подавлялось. Фосфорилирование ERK1/2 было связано обратной зависимостью с экспрессией eNOS, соответствуя предыдущим исследованиям25,26. Данные результаты предполагают, что УНКП помогает VECs сохранять атерозащитный генный профиль и противостоять разрушительному эффекту гиперхолестеринемии.
Одним ограничением настоящего исследования является относительно малое количество образцов, что может повлиять на мощность статистических тестов. Активность ERK показала тенденцию к подавлению у животных, подвергшихся УНКП, по сравнению с гиперхолестеринемическим контролем, но различия не достигли статистической значимости размер образцов, возможно, был недостаточно мощным. Другое ограничение относится к возможной систематической ошибке оценки в гемодинамических допплерографических измерениях, осуществленных тем же самым лаборантом по ультразвуку, от которого не скрывалось назначение группы. К тому же, гемодинамические параметры измерялись в периферической артерии, и поэтому не могут быть использованы напрямую для вынесения какого-либо заключения о напряжении сдвига в коронарном кровообращении. И еще одно ограничение относится к недостатку контрольной группы, которая использовала некоординированную УНКП.
В заключение, настоящее исследование демонстрирует взаимосвязь УНКП-опосредованного повышенного напряжения сдвига с торможением гиперплазии интимы, при поддержании антиатерогенного влияния хронического воздействия напряжение сдвига. Также настоящее исследование предполагает, что УНКП должна рассматриваться как терапевтическая стратегия для лечения больных с атеросклеротическими окклюзирующими заболеваниями.
Клиническая перспектива
Напряжение сдвига на стенках сосудов является, возможно, наиболее важным локальным фактором, влияющим на атерогенез. Сниженное напряжение сдвига, которое превалирует в областях, склонных к атеросклерозу, обычно приводит к атеросклерозу, тогда как физиологическое касательное напряжение на относительно высоком уровне имеет анти пролиферативный и сосудопротективный эффект. В настоящем исследовании усиленная наружная контрпульсация (УНКП) используется как средство увеличения касательного напряжения, в целях определения ее воздействия на гиперплазию интимы, вызванную гиперхолестеринемией. Гистопатологический, морфологический и молекулярный биологический методы для доказательства очевидности свиной модели и для демонстрации того, что УНКП помогает устранить эндотелиальное повреждение, ослабить ремоделирование коллагена, остановить пролиферацию и миграцию гладкомышечных клеток, а также тормозит гиперплазию интимы. Клинически было показано, что УНКП увеличивает продукцию NO и улучшает эндотелий-зависимую дилатацию плечевой артерии. Наша модель делает дальнейший шаг в изучение молекулярных механизмов, лежащих в основе клинических эффектов, достигнутых УНКП. Данные результаты раскрывают новую методику регулирования экспрессии стрессочувствительного гена, предлагая УНКП в качестве действенной лечебной стратегии для предотвращения и лечения атеросклероза.
Список литературы
1. Cunningham KS, Gotlieb AI. The role of shear stress in the pathogenesis of atherosclerosis. Lab Invest. 2005;85:9 –23.
2. Malek AM, Alper SL, Izumo S. Hemodynamic shear stress and its role in 1. atherosclerosis. JAMA. 1999;282:2035–2042. 2. Resnick N, Yahav H, Shay-Salit A, Shushy M, Schubert S, Zilberman LCM, Wofovitz E. Fluid
shear stress and the vascular endothelium: for better and for worse. Prog Biophys Mol Biol. 2003;81:177–199.
3. Arora RR, Chou TM, Jain D, Fleishman B, Crawford L, McKiernan T, Nesto RW. The Multicenter Study of Enhanced External Counterpulsation (MUST-EECP): effect of EECP on exerciseinduced myocardial ischemia and angina episodes. J Am Coll Cardiol. 1999;33: 1833–1840.
4. Urano H, Ikeda H, Ueno T, Matsumoto T, Murohara T, Imaizumi T. Enhanced external counterpulsation improves exercise tolerance, reduces exercise-induced myocardial ischemia and improves left ventricular diastolic filling in patients with coronary artery disease. J Am Coll Cardiol. 2001;37:93–99.
5. Bonetti PO, Barsness GW, Keelan PC, Schnell TI, Pumper GM, Kuvin JT, Schnall RP, Holmes DR, Higano ST, Lerman A. Enhanced external counterpulsation improves endothelial function in patients with symptomatic coronary artery disease. J Am Coll Cardiol. 2003;41:1761–1768.
6. Shechter M, Matetzky S, Feinberg MS, Chouraqui P, Rotstein Z, Hod H. External counterpulsation therapy improves endothelial function in patients with refractory angina pectoris. J Am Coll Cardiol. 2003;42: 2090–2095.
7. Irace C, Cortese C, Fiaschi E, Carallo C, Farinaro E, Gnasso A. Wall shear stress is associated with intima-media thickness and carotid atherosclerosis in subjects at low coronary heart disease risk. Stroke. 2004;35: 464–468.
8. Gnasso A, Carallo C, Irace C, Spagnulo V, Novara GD, Mattioli PL, Pujia A. Association between intima-media thickness and wall shear stress in common carotid arteries in healthy male subjects. Circulation. 1996;94: 3257–3262.
9. Nan KJ, Guo H, Ruan ZP, Jing Z, Liu SX. Expression of p57kip2 and its relationship with clinicopathology, PCNA and p53 in primary hepatocellular carcinoma. World J Gastroenterol. 2005;11:1237–1240.
10. Mattsson EJR, Kohler TR, Vergel SM, Clowes AW. Increased blood flow induces regression of intimal hyperplasia. Arterioscler Thromb Vasc Biol. 1997;17:2245–2249.
11. Lin K, Hsu PP, Chen BP, Yuan S, Usami S, Shyy JYJ, Li YS, Chien S. Molecular mechanism of endothelial growth arrest by laminal shear stress. Proc Natl Acad Sci U S A. 2000;97:9385–9389.
12. Wentzel JJ, Gijsen FJH, Stergiopulos N, Serruys PW, Slager CJ, Krams R. Shear stress, vascular remodeling and neointimal formation. J Biomech. 2003;36:681– 688.
13. Carlier SG, Damme LCA, Blommerde CP, Wentzel JJ, Langehove GV, Verheye S, Kockx MM, Knaapen MWM, Cheng C, Gijsen F, Duncker DJ, Stergiopulos N, Slager CJ, Serruys PW, Krams R. Augmentation of wall shear stress inhibits neointimal hyperplasia after stent implantation. Circulation. 2003;107:2741–2746.
14. Stone PH, Coskun AU, Kinlay S, Clark ME, Sonka M, Wahle A, Ilegbusi OJ, Yeghiazarians Y, Popma JJ, Orav J, Kuntz RE, Feidman CL. Effect of endothelial shear stress on the progression of coronary artery disease, vascular remodeling, and in-stent restenosis in humans: in vivo 6-month follow-up study. Circulation. 2003;108:438–444.
15. Boo YC, Jo H. Flow-dependent regulation of endothelial nitric oxide synthase: role of protein kinases. Am J Physiol. 2003;285:C499–C508.
16. Klein-Nulend J, Helfrich MH, Sterck JGH, MacPherson H, Joldersma M, Ralston SH, Semeins CM, Burger EH. Nitric oxide response to shear stress by human bone cell cultures is endothelial nitric oxide synthase dependent. Biochem Biophys Res Commun. 1998;250:108 –114.
17. Rudic RD, Shesely EG, Maeda N, Smithies O, Segal SS, Sessa WC. Direct evidence for the importance of endothelium-derived nitric oxide in vascular remodeling. J Clin Invest. 1998;101:731–736.
18. Cayatte AJ, Palacino JJ, Horten K, Cohen RA. Chronic inhibition of nitric oxide production accelerates neointimal formation and impairs endothelial function in hypercholesterolemic rabbits. Arterioscler Thromb. 1994; 14:753–759.
19. Varenne O, Pislaru S, Gillijns H. Local adenovirus-mediated transfer of human endothelial nitric oxide synthase reduces luminal narrowing after coronary angioplasty in pigs. Circulation. 1998;98:919 –926.
20. Kaul S, Cercek B, Rengstrom J, Xu XP, Molloy MD, Dimayuga P, Parikh AK, Fishbein MC, Nilsson J, Rajavashisth TB, Shah PK. Polymeric-based perivascular delivery of a nitric oxide donor inhibits intimal thickening after balloon denudation arterial injury: role of nuclear factorkappaB. J Am Coll Cardiol. 2000;35:493–501.
21. Akhtar M, Wu GF, Du ZM, Zheng ZS, Michaels AD. Effect of external сounterpulsation on plasma nitric oxide and endothelin-1 levels. Am J Cardiol. 2006;98:28 –30.
22. Qian XX, Zheng ZS, Wu WK, Chen YM. Effects of external counterpulsation on the nitric oxide and nitric oxide synthase in myocardial infarction canines. Acad J Sun Yat-sen Uni Med Sci. 1999;20:257–260.
23. Niebauer J, Cooke JP. Cardiovascular effects of exercise: role of endothelial shear stress. J Am Coll Cardiol. 1996;28:1652–1660.
24. Martens FMAC, Demeilliers B, Girardot D, Daigle C, Dao HH, deBlois D, Moreau P. Vesselspecific stimulation of protein synthesis by nitric oxide synthase inhibition: role of extracellular signal-regulated kinases 1/2. Hypertension. 2002;39:16 –21.
25. Bao XP, Lu CA, Frangos JA. Mechanism of temporal gradients in shear-induced ERK1/2 activation and proliferation in endothelial cells. Am J Physiol. 2001;281:H22–H29.
