- 🚛 В наличии на складе
-
COVID-19
- Средства индивидуальной защиты
- Кабина дезинфекции
- Ультрафиолетовый облучатель
- Термометр медицинский
- Измеритель АД
- Аппараты ИВЛ
- Увлажнитель кислорода
- Монитор пациента
- Шприцевой насос
- Аспиратор электрический
- Анализатор газов в крови
- Спирометр Пульсоксиметр
- Реабилитация лёгочной дисфункции пациентов, перенёсших Covid-19.
- Аппараты НИВЛ
- Диагностика
- Физиотерапия
- Криотерапия
- Контрпульсация (УНКП)
- Литотриптеры
-
Тепло и грязелечение
- Автоматизированные кухни для Теплолечения
- Система с подогревом для релаксации и грязевых аппликаций Aqua-Relax
- Система для релаксации с нагретым песком Sand Relax
- Инфракрасный теплоизлучатель Theramed 4
- Автоматизированные кухни для Грязелечения
- Мини−кухни для Применения Пакетированных Грязевых Аппликаций
- Системы для Обертываний «Velvet»
- Система пелоидотерапии конечностей
- Одноразовые грязевые аппликации
- Косметология
- Активное долголетие
- Хирургия
- Ветеринария
-
Реабилитация
- Тренажер с универсальной нагрузкой EN-Tree Pulley MDD
- Подвес реабилитационный «Орторент М»
- Аппарат для механотерапии «ОРТОРЕНТ» модель «Актив»
- Аппарат двигательный «Орторент-лучезапястный»
- Тренажер «Орторент Carmina»
- Электростимулятор Cefar Rehab X2
- Система электротерапии VitalStimPlus
- Беговая дорожка детская с БОС «Орторент»
Усиленная наружная контрпульсации не влияет на ауторегуляцию мозгового кровотока
Marthol H, Werner D, Brown CM, Hecht M, Daniel WG, Hilz MJ.
Отделения Неврологии, Кардиологии, Университет Эрланген-Нюрнберга, г. Эрланген, Германия Germany;
Отделение неврологии, Медицинская школа Нью-Йоркского Университета, Нью-Йорк, США
Цели:
Усиленная наружная контрпульсация (УНКП) ритмически повышает АД в результате диастолической компрессии нижней части тела. Недавно, мы продемонстрировали, что средняя скорость мозгового кровообращения (CBFVmean) у молодых здоровых людей во время УНКП снижается, в то время как у пациентов с атеросклерозом CBFVmean не изменяется. В данном исследовании, мы оценили влияние УНКП на динамическую ауторегуляцию мозгового кровотока (CA).
Материалы и методы:
До и в течение 5 мин УНКП мы оценили частоту сердечного ритма (ЧСС), среднее АД (АДmean) и CBFVmean у 23 здоровых добровольцев и у 15 больных с атеросклерозом. Мы проанализировали мощность спектров HR, АДmean и CBFVmean в низком (LF: 0.04-0.15 Hz) и высоком (HF: 0.15-0.5 Hz) диапазоне частот, чтобы определить CA из прироста функции преобразования LF и фазового сдвига между колебаниями АДmean и CBFVmean.
Результаты:
УНКП повышает ЧСС и АДmean, в то время как прирост функции преобразования фазового сдвига не изменяются.
Выводы:
Отсутствие прироста и фазовых значений предполагают, что УНКП не влияет на CA и, следовательно, не несет опасности для сосудов головного мозга.
Ключевые слова: фазовый сдвиг; спектральный анализ; прирост функции преобразования
Усиленная наружная контрпульсация (УНКП) – это неинвазивная альтернатива контрпульсации внутриаортальным баллоном (IABP) для лечения пациентов с ИБС, инфарктом миокарда, застойной сердечной недостаточностью или кардиогенным шоком (1).
Чтобы выполнить УНКП, три пары надуваемых манжет оборачиваются вокруг нижней части тела, в том числе ног, бедер и ягодиц (1, 2). В начале диастолы давление последовательно нагнетается в манжеты начиная с ног, далее к бедрам и ягодицам, что приводит к аортальной контрпульсации и повышению венозного возврата (2, 3).
Наряду с аортальной контрпульсацией, т.е. механической сменой внутриартериального пула крови, в направлении к аорте и сосудам дуги аорты, наблюдается увеличение диастолического объема крови и АД. Более того, диастолическая компрессия манжет приводит к повышению венозного возврата к правому желудочку и, следовательно, повышенному дебиту правого желудочка и преднагрузке левого желудочка (1-3). Кроме того, стравливание давления в манжетах в начале систолы приводит к снижению постнагрузки левого желудочка и, следовательно, к более низкой потребности левого желудочка в кислороде. Более низкая потребность в кислороде, в свою очередь, может улучшить функцию левого желудочка, что может способствовать повышению сердечного выброса (2). В контрольной группе здоровых добровольцев и пациентов с атеросклерозом, аортальная контрпульсация, как и повышенный сердечный выброс сердца, способствует увеличению аугментации среднего АД (4). Предыдущие исследования показали, что УНКП увеличивает миокардиальный, печеночный и почечный кровоток, как и скорость кровотока в сонной артерии (1, 4).
В нашем, ранее выполненном исследовании (5), мы наблюдали увеличение среднего АД во время сеанса УНКП у молодых добровольцев и у более взрослых пациентов с атеросклерозом. В ответ на повышение АД у молодых добровольцев наблюдали слабое, но заметное снижение средней скорости мозгового кровотока (CBFV), в то время как у пациентов с атеросклерозом CBFV оставалась постоянной. Мы предположили, что снижение CBFV, наблюдаемое у молодых участников, является избыточной реакцией неповрежденной мозговой ауторегуляции (CA), тогда как пациенты с атеросклерозом, возможно, не смогли адекватно прореагировать на повышение АД, вызванное УНКП(5).
Обычно, мозговое кровообращение остается постоянным, несмотря на колебания АД, таких как, например, колебания АД, вызванные УНКП. Различные механизмы обеспечивают CA (6). Миогенный компонент, или компонент Бэйлиса (Bayliss) обеспечивает внутреннюю контрактильную способность гладкой мускулатуры сосудов в ответ на повышенное системное АД (7). Нейрогенные механизмы в большей степени зависят от интактной симпатической и, в меньшей степени, от парасимпатической иннервации (7, 8). Кроме того, различные нейрогуморальные, метаболические и эндотелиальные механизмы, которые в большой степени зависят от интактной эндотелиальной функции, способствуют стабильной регуляции CBF (6).
Обнаружение негативного влияния УНКП на динамическую функцию CA нанесло бы ущерб применению этой технологии, например при лечении пациентов с ИБС, а также могло бы обозначить УНКП как противопоказание для пациентов с распространенным атеросклерозом. Пока, в настоящий момент, влияние на динамическую CA у здоровых людей и пациентов с атеросклерозом не изучено.
Исследование проводили для количественной оценки динамической СА во время сеанса УНКП у группы, состоящей из молодых здоровых добровольцев, и у группы боле взрослых пациентов с атеросклерозом, с использованием фазы функции преобразования и анализа прироста между колебаниями АД и CBFV во время УНКП.
Материалы и методы
Мы повторно оценивали сигналы АД и CBFV у 23 молодых здоровых добровольцев (7 – женского пола, 16 - мужского, средний возраст 27.9 ± 4.0 лет, диапазон 21-36 лет) и у 15 более взрослых пациентов с выраженным атеросклерозом (5 – женского пола, 10 - мужского, средний возраст 64.0 ± 7.3 лет, диапазон 52-75 лет), у которых мы до этого оценивали влияние УНКП на АД и CBFV (5). В случае с пациентами, диагноз атеросклероза основывался на данных, по крайней мере, одного стеноза коронарной артерии с необходимостью интервенционного вмешательства и на наличии по крайней мере двух факторов риска атеросклероза. Факторы риска включали артериальную гипертензию, сахарный диабет, курение, гиперхолестеринемию, пожилой возраст и ожирение, определенное по индексу массы тела составляющим по крайней мере 30 кг/м2 (9).
Ни у одного из пациентов в анамнезе не было других клинически важных системных заболеваний, в частности, неврологической патологии (5). Перед началом тестов, было проведено дуплексная сонография внечерепных артерий, чтобы исключить значимый стеноз сонной артерии.
Комитет по этике Университета Эрлангер-Нюрнберга утвердил проведение исследования. От каждого участника было получено письменно согласие в соответствии с Хельсинской декларацией.
Процедуры
Все тесты проводили после обеда между 14:00 и 18:00. Пациенты и здоровые добровольцы во время тестов находились в расслабленном и комфортном положении в тихой комнате со стабильными условиями окружающей среды. Всех участников попросили не употреблять никотин, кофеин и алкоголь за 18 ч до теста. Перед началом тестов пациенты и добровольцы отдыхали в течение, по крайней мере, 30 мин для того, чтобы обеспечить стабильную симпатическую и
парасимпатическую сердечно-сосудистую модуляцию.
Мы непрерывно оценивали ЧСС с помощью стандартной ЭКГ с 5 отведениями от поверхностных кожных электродов, прикрепленных под правой и левой ключицами, правым и левым подвздошным гребнем и грудной клеткой. Мы непрерывно регистрировали АД в левой лучевой артерии на запястье с помощью неинвазивной аппланационной тонометрии (пациент держал при этом руку на уровне сердца). Тонометр состоит из комплекта из 31 расположенных на равных интервалах пьезорезистивных датчиков давления, автоматизированной системы позиционирования и устройства преобразования сигнала и первоначальной градуировки путем осциллометрического измерения манжет левой плечевой артерии (Colin PilotTM; Colin Medical Instruments Corp., San Antonio, Техас, США). Чтобы исключить возможное вмешательство механических артефактов, вызванных УНКП, в непрерывное измерение АД монитором «Colin monitor» путем аппланационной тонометрии, мы поместили левое предплечье и руку на мягкую шину и на мягкую подушку, ослабляющую любые динамические движения в течение процедуры УНКП. Кроме того, мы проверяли надежность непрерывных значений АД, измеряемых в течение процедуры УНКП, путем повторного сравнения непрерывно измеряемых значений АД и значений, полученных с помощью общепринятого осциллографического измерения на уровне плечевой артерии до и после УНКП. Мы регистрировали пики систолического, конечно- диастолического АДs (АДsys, АДdia), пик АД повышенный УНКП во время диастолы (АДaug), и среднее АД усредненное за весь цикл АД (АДmean). Среднюю и увеличеннюю скорость мозгового кровотока (CBFVmean and CBFVaug) получали из проксимального сегмента средней мозговой артерии (СМА) с помощью транскраниальной доплеровской сонографии (Multidop XLTM; DWL, Зипплингер, Германия). СМА лоцировали через височное окно приблизительно на 1 см выше челюстной дуги на глубине 35-55 мм с частотой импульсов 2 MHz. Чтобы обеспечить надежность значений CBFV в течение УНКП из-за артефактов, вызванных движением, мы в первую очередь настроили индивидуальные сигналы TCD, выбрав глубину локации от 35 до 55 мм. При анализе, когда мы сравнивали значения CBVF каждого пациента в отдельности до УНКП с ее/его значениями CBFV в течение УНКП, но мы не сравнивали значения одного человека со значениями других людей, инсонированных на другой глубине. После оптимизации доплеровского сигнала, зонд прикреплялся к черепу с фиксированным углом с помощью повязки с настраиваемой системой позиционирования.
Все параметры фиксировались в покое и во время процедуры УНКП в течение 90 секунд. До УНКП время пробы заканчивалось за 90 сек до начала УНКП для избежания любого побочного влияния подготовительных процедур. Во время УНКП время пробы начинались через 3 мин после запуска УНКП, т.е. после начального периода сердечно-сосудистой и ментальной адаптации к контрпульсации. Частота дыхания была 12 циклов в минуту (cpm) (0.2 Hz). Чтобы ознакомить участников исследования с частотой дыхания до исследования, их обучали следовать визуальным и словесным сигналам на вдох и выдох в течение 5 сек, т.е. перебить их нормальную частоту дыхания. Участники исследования должны были следовать дыхательному режиму 12 cpm, чтобы избежать помех, связанных с дыханием, автономной мозговой и сердечно-сосудистой модуляциями, а также обеспечить высокую стабильность биосигналов во время УНКП. Чтобы убедиться, что частота дыхания была постоянна, мы отслеживали ее с помощью индуктивного плетизмографа с двумя ремнями для грудной клетки и живота (Respitrace CalibratorTM; Ambulatory Monitoring Inc., Ardsley, Нью-Йорк, США). Во время УНКП запускаемое электрокардиограммой диастолическое давление, приблизительно равное 250 мм рт. ст., ритмически и последовательно прилагалось к сосудистому ложе икр, бедер и ягодиц с помощью трех пар пневматических манжет (EECP®, Vasomedical Inc., Westbury, NY, USA). Пальцевая плетизмография применялась для фиксирования реакции АД на УНКП и для оптимизации диастолического усиления АД путем настраивания временного промежутка между R-волной электрокардиограммы и началом волны контрпульсации.
Получение данных и их анализ
Все биосигналы передавались через аналоговое выходное устройство в систему получения данных и их анализа, настроенную под клиента (HRviewTM; Boston Medical Technologies, Wakefield, MA, USA). Аналоговые данные оцифровывались через 32-канальный аналоговый цифровой конвертер с разрешением 16-бит (CIO-DAS64-02/ 16; ComputerBoards Inc., Mansfield, MA, USA). Все данные передавались на персональный компьютер, дискретировались на 1 kHz и сохранялись для автономного анализа. Из 90-секундных интервалов вы высчитали средние значения и стандартные отклонения всех биосигналов. (5). Кроме того, мы оценили сопротивление сосудов мозга (CVR) как отношение АДmean на уровне локации и CBFVmean (10). Все измерения выполняли, когда пациенты лежали в положении на спине. Считалось, что АДmean на уровне локации близко соответствует АДmean артерии на уровне запястья. Следовательно, CVR вычислялся делением АДmean на CBFVmean.
Спектральный анализ
Чтобы оценить воздействие симпатической и парасимпатической систем на ЧСС, АД и CBFV, мы оценивали вариабельность ЧСС, АД и CBFV с помощью спектрального анализа (11). Для целей спектрального анализа мы вручную очистили 90 сек. записи биосигналов до и во время УНКП от артефактов с помощью линейной интерполяции, преобразовали их на 4 Hz, а затем провели спектральную обработку с помощью алгоритма Блэкмана-Таки (Blackman-Tukey algorithm) (12, 13). Значения ЧСС, АД и CBFV показали медленные основные колебания, которые в значительной мере были опосредствованы волнообразной активностью симпатической и парасимпатической нервными системами (14-16). Симпатические и парасимпатические влияния на вариабельность ЧСС, АД и
CBFV оценивали измерением мощности спектра низкой частоты (LF: 0.04-0.15 Гц) и высокой частоты (HF: 0.15-0.5 Гц). Широта этих колебаний определялась как интеграл по кривым спектральной плотности мощности и выражалась как LF- и HF-мощности ЧСС (bpm2), АД (mmHg2) и CBFV (см2/с2) (12, 15).
Так как изменения LF- и HF-мощностей ЧСС могут происходить из-за изменений общей мощности (11), то мы нормализовали LF- и HF-мощности, чтобы более точно измерить симпатическую и парасимпатическую сердечные модуляции (11). Для нормализации мощностей мы разделили LF- или HF-мощности на сумму LF- и HF-мощностей и умножили получившийся результат на 100 (17).
Можно считать, что механизмы СА отражают фильтр верхних частот, который смягчает медленные колебания АД, но пропускает быстрые колебания, такие как пульсирующие сигналы волн АД и CBF (18, 19). Чтобы оценить динамическую ауторегуляцию, мы оценивали переход колебаний АД в осцилляции в CBFV, выполняя анализ функции преобразования и вычисляя прирост функции преобразования и фазовый сдвиг между АДmean и CBFVmean в диапазоне низких частот, при условии,что наблюдалась значительная связь между обоими сигналами (19-21).
В пределах диапазона низких частот, связь между осцилляциями АДmean и CBFVmean может быть оценена от 0 (т.е. нет связи) до 1 (т.е. максимальная связь) (11). В случае если связь была 0.5 или выше, то мы считали, что два сигнала имеют стабильное фазовое соотношение к данной частоте осцилляции, и сигналы считались синхронизированными друг с другом, следовательно, вычислялись прирост LF и фазовый сдвиг между колебаниями CBFV и BP.
Скорость мозгового кровообращения в СМА зависит не только от CVR нисходящих резистивных сосудов, но и напрямую от изменений сопротивляемости сосудов во всех других параллельных связанных частей циркуляторной системы. Следовательно, чтобы оценить динамическую СА, нужно измерять не только CVR. Динамическая CA связана с CVR только не напрямую, так как динамическая СА вычисляется как прирост функции преобразования между мощностями АДmean и CBFVmean в симпатически опосредствованном диапазоне низких частот осцилляций сигналов. Чтобы настроить эти мощности на межиндивидуальные различия, вытекающие из разных для каждого участника исследования значений АДmean или CBFVmean, динамическую CA необходимо оценивать нормализацией прироста LF-мощностей АДBPmean и CBFVmean по индивидуальным значениям АД и CBFV (10, 18, 22). Следовательно, значения прироста функции преобразования, т.е. отношение LF мощностей CBFVmean к LF мощностям АДmean нормализуются значениями АДmean и CBFVmean, т.е. умножаются на значение, которое получается идентичным со значением CVR (CVR = BPmean разделить на CBFVmean) и выражается как нормализованный прирост в произвольных единицах (a.u.) (18).
Статистический анализ
Все данные представлены как М ± SD. Для определения влияния УНКП на сердечнососудистую регуляцию и параметры CА мы применяли двухсторонний критерий Вилкоксона (Wilcoxon) для дальнейшего сравнения биосигналов до и во время УНКП у каждой группы. Уровень значимости был установлен как P < 0.05.
Результаты
Значения ЧСС, АД, CBFV, LF- и HF-мощности и прироста, и фазового сдвига между колебаниями АД и CBFV обобщены в табл.1.
Таблица 1. Результаты, зарегистрированные до и в течение процедуры УНКП
| Группа |
До УНКП | В течение УНКП | Wilcoxon (P-значение) |
| ЧСС уд. в мин |
|||
| Пациенты |
69.7 ± 9.4 | 73.6 ± 9.1 | <0.01 |
| Контрольная группа |
72.7 ± 9.0 | 75.6 ± 8.6 | <0.05 |
| LFnu сердечного ритма (%) | |||
| Пациенты |
41.0 ± 18.3 | 47.4 ± 17.0 | >0.05 |
| Контрольная группа |
33.9 ± 19.9 | 35.9 ± 16.0 | >0.05 |
| HFnu сердечного ритма (%) |
|||
| Пациенты |
59.0 ± 18.3 | 52.6 ± 17.0 | >0.05 |
| Контрольная группа |
66.1 ± 19.9 | 64.1 ± 16.0 | >0.05 |
| АДmean (ммHg) | |||
| Пациенты |
86.4 ± 20.0 | 92.4 ± 24.1 | <0.01 |
| Контрольная группа |
83.4 ± 10.2 | 86.2 ± 9.8 | <0.05 |
| LF-мощность АДmean, (ммHg2) | |||
| Пациенты |
3.1 ± 2.1 | 1.1 ± 0.8 | <0.05 |
| Контрольная группа |
2.7 ± 2.0 | 1.2 ± 1.0 | <0.01 |
| HF-мощность АДmean (ммHg2) | |||
| Пациенты |
3.0 ± 2.4 | 2.3 ± 2.3 | >0.05 |
| Контрольная группа |
1.5 ± 1.3 | 3.0 ± 2.5 | <0.01 |
| BPaug (ммHg) | |||
| Пациенты |
100.4 ± 23.9 | ||
| Контрольная группа |
114.7 ± 13.3 | ||
| CBFVmean (cm/s) | |||
| Пациенты |
46.7 ±11.5 | 47.0 ±11.8 | >0.05 |
| Контрольная группа |
55.0 ± 18.5 | 50.1 ± 17.0 | <0.05 |
| LF-мощность CBFVmean (cм2/с2) | |||
| Пациенты |
2.6 ± 1.9 | 2.4 ± 2.4 | >0.05 |
| Контрольная группа |
2.0 ± 1.2 | 2.6 ± 2.1 | >0.05 |
| HF-мощность CBFVmean (cм2/с2) | |||
| Пациенты |
1.9 ± 1.2 | 2.7 ± 2.2 | >0.05 |
| Контрольная группа s |
2.0 ± 2.2 | 3.0 ± 2.8 | 0.01 |
| CBFVaug (cm/s) | |||
| Пациенты |
51.4 ± 11.9 | ||
| Контрольная группа |
61.0 ± 15.0 | ||
| CVR ¼ BPmean/CBFVmean (ммHg/сcм) |
|||
| Пациенты |
1.9 ±0.7 | 2.0 ± 0.8 | >0.05 |
| Контрольная группа |
1.6 ±0.5 | 1.9 ± 0.5 | <0.01 |
| Прирост LF между АД и CBFV (cм/с/ммHg) | |||
| Пациенты |
0.8 ± 0.3 | 1.1 ± 0.8 | >0.05 |
| Контрольная группа |
0.8 ± 0.3 | 1.0 ± 0.5 | >0.05 |
| Прирост LFmean = прирост x | |||
| АДmean/CBFVmean(a.u.) | |||
| Пациенты |
1.2 ±0.3 | 1.6 ±0.7 | >0.05 |
| Контрольная группа |
1.1 ±0.4 | 2.1 ± 1.6 | >0.05 |
| Фаза LF между АД и CBFV (градусы) | |||
| Пациенты |
52.6 ± 25.8 | 53.4 ± 65.3 | >0.05 |
| Контрольная группа |
44.7 ± 14.3 | 53.8 ± 25.2 | >0.05 |
| Все данные представлены как М ± SD. P-значения < 0.05 указывают на значимую разницу между значениями, записанными до и во время УНКП. ЧСС– частота сердечного ритма; АДmean - среднее АД; АДaug – аугментированное диастолическое АД; CBFVmean – средняя скорость мозгового кровообращения; CBFVaug - аугментированная скорость мозгового кровообращения; CVR – сопротивляемость сосудов мозга; LF – низкая частота; HF – высокая частота; LFnu, нормализованная LF-мощность = LF-мощность/(LF-мощность + HF-мощность) х 100; HFnu, нормализованная HF-мощность = HF-мощность/(LF-мощность + HF-мощность) х 100; Приростnorm, нормализованный прирост = прирост х BPmean/CBFVmean; a.u., произвольные единицы. |
|||
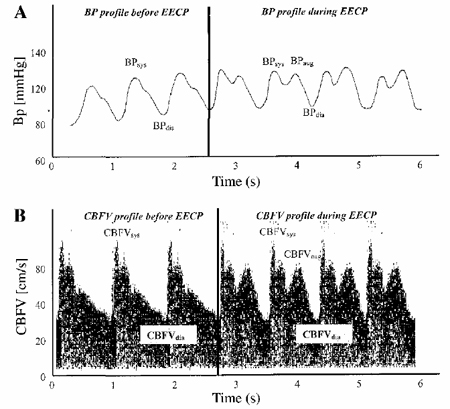
Рисунок 1. Формы волн АД (A) и скорости мозгового кровотока (CBFV) (B) до и в течение УНКП. УНКП вызывает второй пик АД и CBFV во время диастолы (АДaug, CBFVaug). (АД sys, пик систолического АД; АДdia, конечное диастолическое АД; CBFVsys, пиковая систолическая скорость мозгового кровообращения; CBFVdia, конечная диастолическая скорость мозгового кровообращения).
Здоровые добровольцы
В случае со здоровыми людьми УНКП вызывала типичный аугментированный диастолический пик АДaug и CBFV (CBFVaug; рис. 1). ЧСС и АДmean были значительно выше во время УНКП, а CBFVmean была значительно меньше во время УНКП по сравнению с исходным уровнем, о чем писалось ранее (5). В отличие от этого, значения CVR были выше во время УНКП по сравнению с исходным уровнем (P < 0.01).
Нормализованные LF- и HF-мощности HR значимо не изменялись под воздействием УНКП. В отличие от этого, LF-мощность АДmean была ниже во время УНКП, чем на исходном уровне (P < 0.01). Механически вызванные HF-мощности АДmean и CBFVmean, однако, были значительно выше во время УНКП чем на исходном уровне (P < 0.01). Симпатически опосредствованная LF-мощность CBFVmean оставалась неизменной во время УНКП у здоровых людей.
Подобным же образом, абсолютные и нормализованные значения прироста функции преобразования и фазового сдвига оставались неизменными во время УНКП (Рис. 3).
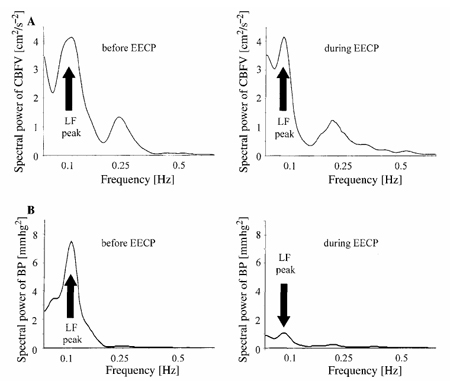
Рисунок 2. Спектральный анализ модуляции средней скорости мозгового кровообращения (CBFVmean) (A) и среднего кровяного давления (BPmean) (B) до и в течение усиленной наружной контрпульсации (УНКП) у 65-летних пациентов с атеросклерозом. LF-мощность BPmean была ниже в течение УНКП, чем до УНКП. УНКП могла стимулировать артериальные барорецепторы, приводя тем самым к симпатическому отмену. LF-мощность CBFVmean не изменилась в течение УНКП. Следовательно, изменения колебаний LF кровяного давления были перенесены не полностью на систему сосудов мозга, что указывает на неповрежденную динамическую мозговую ауторегуляцию.
Пациенты с атеросклерозом
Несмотря на старший возраст и наличие атеросклероза, у пациентов наблюдались изменения сердечно-сосудистых параметров, которые были довольно схожи с изменениями параметров здоровых людей.
Так же как и у здоровых людей, у пациентов отмечали значительно большие значения ЧСС и АДmean во время УНКП по сравнению с исходным уровнем. УНКП также приводила к типичному усилению АД и аугментированной CBFV во время диастолы, как мы писали ранее (5) (рис. 1). В отличие от молодых людей, CBFVmean не уменьшалась (5), а CVR не увеличивалась, оставалась неизменной во время УНКП.
LF-мощность АДmean также была ниже во время УНКП (P < 0.05), в то время как LF-мощность CBFVmean оставалась неизменной во время УНКП (Рис. 2). УНКП не повлияла на HF-мощности АДmean и CBFVmean. Так же как, и у здоровых лиц, УНКП не изменила прирост функции преобразования и фазовый сдвиг у более взрослых пациентов. Нормализованный прирост функции преобразования также оставался неизменным (рис. 3).
Обсуждение
В результате нашего исследования мы пришли к двум основным выводам, касающимся центральной и периферической автономной модуляции в течение процедуры УНКП у здоровых людей и пациентов с атеросклерозом. УНКП не влияет на динамическую СА в обеих группах, что доказывается неизменными значениями прироста функции преобразования и фазового сдвига между осцилляциями АД и CBFV, и EECP не имеет сильного влияния на автономную сердечнососудистую модуляцию.
В обеих группах (молодые здоровые участники и более взрослые пациенты с атеросклерозом) УНКП типично увеличивала АД и CBFV во время диастолы и повышала среднее АД (5). Основная разница между группами заключалась в том, что наблюдали легкое, но заметное уменьшение средней CBFV (с 55.0 до 50.1 см/с) и увеличение CVR в группе здоровых, а в группе пациентов УНКП никак не повлияла на CBFVmean и CVR. Мы же ожидали, что CBFV останется неизменной с адекватной CA, несмотря на изменения АД во время УНКП.
Мы предположили, что уменьшение CBFV, наблюдаемое у молодых участников исследования, является избыточной реакцией неповрежденной CA на более высокую частоту увеличения АД во время УНКП с двумя раздражителями в одном сердечном цикле и на увеличение среднего АД. Мы допустили, что ауторегуляционная реакция молодых участников вызвала снижение сопротивления сосудов мозга вниз по направлению от зоны локации, в то время как, пациенты не смогли прореагировать таким же образом из-за ограниченной эластичности сосудов.
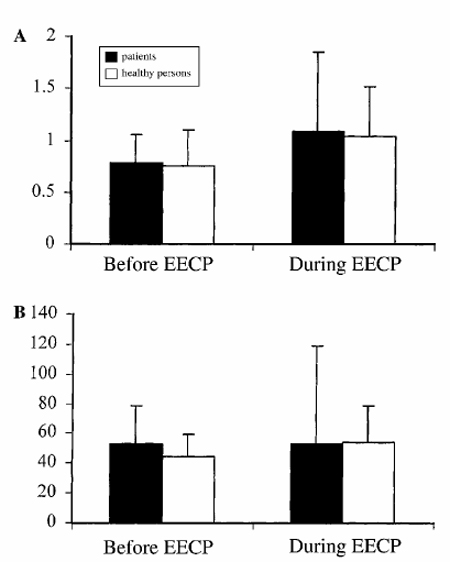
Рисунок 3. Прирост функции преобразования (A) и фазовый сдвиг (B) между колебаниями среднего кровяного давления (BPmean) и средней скорости мозгового кровообращения (CBFVmean) в диапазоне низких частот у 15 пациентов с атеросклерозом и 23 здоровых людей до и в течение УНКП. Прирост функции преобразования, как и фазовый сдвиг, оставались неизменными в обеих группах, что указывает на то, что УНКП не влияет на динамическую мозговую ауторегуляцию.
Из-за снижения систолического пика и торого повышения АД во время УНКП, профиль АД сглажен, что приводит к более ламинарному напряжению сдвига. Было предположено, что ламинарное напряжение сдвига влечет за собой дилатацию сосудов, например, из-за высвобождения окиси азота. Следовательно, уменьшение CBFV в проксимальной СМА у здоровых добровольцев может быть не только из-за констрикции мозговых сосудов вниз по направлению от зоны локации, но, и возможно, изза дилатации проксимального участка СМА в результате высвобождения окиси азота вызванное напряжением сдвига (23-25). По аналогии, мы предположили, что CBFV у пациентов оставалась неизменной во время УНКП, потому что атеросклеротические изменения стенок сосудов и сниженный выброс окиси азота привели к меньшей степени констрикции внутримозговых сосудов, и стали причиной меньшей NO дилатации проксимального сегмента СМА. Следовательно, у пациентов с атеросклерозом, местная дилатация СМА могла быть менее выраженной. Однако, так как мы не верифицировали патологию малых церебральных сосудов прямыми способами, такими как магнитно-резонансная томография, мы не в состоянии продемонстрировать тот факт, что у наших пациентов на самом деле был церебральный атеросклероз.
В некоторых сигналах наблюдаются медленные основные колебания, которые опосредствованы в большой степени волнообразной активностью автономной нервной системы (14-16). Парасимпатические модуляции ЧСС наиболее связаны с дыханием, например частота 0,2 Гц с ритмом дыхания 12 cpm (12, 14-16). Считается, что парасимпатические респираторные воздействия в ответе за модуляцию ЧСС, которая отражается в так называемом диапазоне высоких частот (HF) от 0.15 до 0.5 Гц (12, 14-16). Следовательно, мы использовали модуляции ЧСС в диапазоне высоких частот как индекс парасимпатической модуляции (12, 14-16).
Напротив, колебания сигналов АД и CBFV в высоком диапазоне частот являются в первую очередь механическим следствием повышения венозного возврата, вызванного дыханием (12, 14-16). Однако, на частоте ниже 0.15 Гц все еще встречаются парасимпатические воздействия, в то время как считается, что колебания сигналов АД и CBFV в так называемом низком диапазоне частот между 0.04 и 0.15 Гц связаны только с симпатическим отделом нервной системы (12, 14-16). Следовательно, мы определили степень симпатической модуляции сигнала из величины модуляций АД и CBFV в низком диапазоне частот (12, 14-16).
И у пациентов и у добровольцев отмечалась сходная адаптация их симпатически опосредствованной модуляции во время контрпульсации. В обеих группах наблюдали снижение LF-мощностей АДmean во время УНКП. Вытягивание симпатической модуляции АД может быть вызвано стимуляцией барорецепторов. Норман и Кеннеди (Normann and Kennedy) предположили, что наличие двух пиковых давлений в одном сердечном цикле может стимулировать артериальные барорецепторы (26). Кроме того, повышенное среднее АД во время УНКП может способствовать повышенной барорецепторной активности (11). Снижение симпатической активности во время УНКП должно привести к снижению ЧСС. До сих пор мы наблюдали повышение ЧСС в обеих группах. Мы предположили, что влияние повышенного венозного возврата и центрального венозного давление во время контрпульсации (3) доминирует над любым барорефлексом, опосредующим снижение ЧСС, и приводит к увеличению ЧСС. Кроме того, снижение АД во время УНКП может вызвать разгрузку барорецепторов, приводящую к кардио-вагальной абстиненции и симпатической активизации, что может также внести свой вклад в ускорение ЧСС.
Наоборот, модуляции АД на низких частотах, LF-мощности CBFVmean не изменялись во время контрпульсации в обеих группах. Это расхождение между симпатической модуляцией АД и CBFV указывает на то, что изменения в колебаниях LF АД не были полностью перенесены на систему сосудов мозга (6, 7, 27). Таким образом, полученные данные о сохраненной симпатической модуляции CBFV при уменьшенной симпатической модуляции АД указывают на то, что динамическая CA, т.е. способность церебральных резистивных сосудов амортизировать низкочастотные колебания АД, оставалась неповрежденной не только у здоровых, но и у пациентов с атеросклерозом.
Более того, УНКП не влияет на прирост функции преобразования или фазовый сдвиг между осцилляциями АД и CBFV. Вычисления прироста функции преобразования и фазового сдвига были достаточно хорошо установлены для оценки динамической СА и обеспечивают более точный анализ реакции ауторегуляции на УНКП.
Анализ функции преобразования осцилляций среднего АДmean как входных сигналов СА и осцилляций CBFVmeanи и выходных сигналов можно использовать для вычисления прироста между обоими параметрами. Этот прирост отражает степень, в которой наблюдается передача колебаний АД на колебания CBFV или амортизация этих колебаний путем механизма ауторегуляции (11, 19). Низкий пророст функции преобразования указывает на достаточную амортизацию колебаний АД церебральными резистивными сосудами, т.е. неповрежденную CA (11, 19).
Кроме того, фазовое соотношение между осцилляциями АДmean и CBFVmean можно использовать для определения качества CA. Дил и др. (Diehl et al.) показали, что осцилляции АД, вызванные ритмом дыхания 6 cpm вырабатывают похожие осцилляции CBFV, которые не только смягчаются, но также сдвигаются влево из-за действия СА как фильтра высоких частот (11, 20). Повышение АД, вызванное равномерным дыханием активирует СА. Ауторегуляция вызывает контррегуляцию сосудистого резистивного ложа с сужением кровеносных сосудов. Эта контррегуляция приводит к тому, что CBFV достигает максимального значения до того, как повышение АД достигнет своего максимума. В то время, как АД достигает максимума, саморегуляционные эффекты уже начинают замедлять CBFV. Когда в итоге АД снижается, CBFV снижается еще быстрее из-за продолжительной реакции на предшествующее повышение АД. По мере дальнейшего снижения АД, ауторегуляция начинает противостоять снижению CBFV путем дилатации резистивного ложа. И опять, CBFV достигает своего минимального значения до того, как АД достигнет своего. Следовательно, CBFV восстанавливается до следующего подъема АД. Это соотношение между осцилляциями АД и CBFV можно описать вычислением фазового сдвига между опережающим сигналом CBFV и запаздывающим сигналом АД (11, 20). Согласно Дилу и др. ( Diehl et al.), фазовый сдвиг между осцилляциями АД и CBFV, вызванный равномерным дыханием со скоростью 6 cpm, составляет от 30 до 90°. Понижение фазового угла ниже этих нормальных значений указывает на более пассивное поведение церебрального резистивного ложа, и является признаком
поврежденной CA (11, 18, 20).
Стабильность обоих параметров во время УНКП подтверждает предположение, сделанное во время нашего прежнего анализа (5) CBFV о том, что УНКП не подвергает риску СА. Очевидно, что УНКП не ослабляет механизмы, защищающие церебральные сосудистые ложа от изменений АД и поддерживающие стабильность церебрального кровообращения путем смягчения осцилляций BP.
В заключение, настоящее исследование подтверждает тот факт, что УНКП не подвергает риску динамические механизмы СА. Прирост функции преобразования и фазовый сдвиг между осцилляциями АД и CBFV остаются неизменными во время контрпульсации не только у молодых здоровых лиц, но и у группы более взрослых пациентов с атеросклерозом, для которых УНКП может стать альтернативным методом лечения ИБС. Для этих пациентов УНКП, по всей видимости, не представляет опасности, как например риск неадекватного увеличения церебральной перфузии с последующими осложнениями, такими как кровоизлияние в мозг (5).
В настоящем исследовании мы не пытались оценить возможные побочные эффекты УНКП на мозговое кровообращение или ауторегуляцию у любых пациентов с высоким риском и в критическом состоянии. Соответственно, мы не можем исключить противопоказания для лечения пациентов в критическом состоянии, например пациентов в кардиогенном шоке с низким АД. Фактически, если применять УНКП для лечения пациентов во время кардиогенного шока и с низким АД, то может возникнуть неадекватная коронарная перфузия и изменение СА.
Список литературы
1. Applebaum RM, Kasliwal R, Tunick PA et al. Sequential external counterpulsation increases cerebral and renal blood flow. Am Heart J 1997;133:611–5.
2. Suresh K, Simandl S, Lawson WE et al. Maximizing the hemodynamic benefit of enhanced external counterpulsation.Clin Cardiol 1998;21:649–53.
3. Taguchi I, Ogawa K, Oida A, Abe S, Kaneko N, Sakio H. Comparison of hemodynamic effects of enhanced external counterpulsation and intra-aortic balloon pumping in patients with acute myocardial infarction. Am J Cardiol 2000;86:1139–41.
4. Werner D, Schneider M, Weise M, Nonnast-Daniel B, Daniel WG. Pneumatic external counterpulsation: a new noninvasive method to improve organ perfusion. Am J Cardiol 1999;84:950–2.
5. Werner D, Marthol H, Brown CM, Daniel WG, Hilz MJ. Changes of cerebral blood flow velocities during enhanced external counterpulsation (EECP). Acta Neurol Scand 2003;107:405–11.
6. Hilz MJ, Stemper B, Heckmann JG, Neundo.rfer B. Mechanisms of cerebral autoregulation, assessment and interpretation by means of transcranial Doppler sonography. Fortschr Neurol Neurochir Psych 2000;68:398–412.
7. Ursino M. Mechanisms of cerebral blood flow regulation. Crit Rev Biomed Eng 1991;18:255–88.
8. Ohta K, Gotoh F, Shimazu K et al. Locus coeruleus stimulation exerts different influences on the dynamic changes of cerebral pial and intraparenchymal vessels. Neurol Res 1991;13:164–7.
9. Grundy SM, Pasternak R, Greenland P, Smith S Jr, Fuster V. Assessment of cardiovascular risk by use of multipleriskfactor assessment equations: a statement for healthcare professionals from the American Heart Association and the American College of Cardiology. Circulation 1999;100:1481–92.
10. Schondorf R, Benoit J, Wein T. Cerebrovascular and cardiovascular measurements during neurally mediated syncope induced by head-up tilt. Stroke 1997; 28:1564–8.
11. Hilz MJ. Quantitative autonomic functional testing in clinical trials. In: Brown R, Bolton C, Aminoff M, eds. Neuromuscular function and disease, Philadelphia: W.B. Saunders Company, 2002;1899–929.
12. Hilz MJ, Stemper B, Sauer P, Haertl U, Singer W, Axelrod FB. Cold face test demonstrates parasympathetic cardiac dysfunction in familial dysautonomia. Am J Physiol 1999;276:R1833–9.
13. Hilz MJ, Axelrod FB, Braeske K, Stemper B. Cold pressor test demonstrates residual sympathetic cardiovascular activation in familial dysautonomia. J Neurol Sci 2002;196:81–9.
14. Saul JP, Berger RD, Albrecht P, Stein SP, Chen MH, Cohen RJ. Transfer function analysis of the circulation: unique insights into cardiovascular regulation. Am J Physiol 1991;261:H1231–45.
15. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability: standards of measurement, physiological interpretation, and clinical use. Circulation 1996;93:1043–65.
16. Bernardi L, Passino C, Robergs R, Appenzeller O. Acute and persistent effects of a 46-kilometer wilderness trail run at altitude: cardiovascular autonomic modulation and baroreflexes. Cardiovasc Res 1997;34:273–80.
17. Pagani M, Lombardi F, Guzzetti S et al. Power spectral analysis of heart rate and arterial pressure variabilities as a marker of sympatho-vagal interaction in man and conscious dog. Circ Res 1986;59:178–93.
18. Blaber AP, Bondar RL, Stein F et al. Transfer function analysis of cerebral autoregulation dynamics in autonomic failure patients. Stroke 1997;28:1686–92.
19. Zhang R, Zuckerman JH, Giller CA, Levine BD. Transfer function analysis of dynamic cerebral autoregulation in humans. Am J Physiol 1998;274:H233–41.
20. Diehl RR, Linden D, Lucke D, Berlit P. Phase relationship between cerebral blood flow velocity and blood pressure. A clinical test of autoregulation. Stroke 1995;26:1801–4.
21. Saul JP, Berger RD, Chen MH, Cohen RJ. Transfer function analysis of autonomic regulation. II. Respiratory sinus arrhythmia. Am J Physiol 1989;256:H153–61.
22. Brys M, Brown CM, Marthol H, Franta R, Hilz MJ. Dynamic cerebral autoregulation remains stable during physical challenge in healthy persons. Am J Physiol Heart Circ Physiol 2003;285:H1048–54.
23. Paszkowiak JJ, Dardik A. Arterial wall shear stress: observations from the bench to the bedside. Vasc Endovascular Surg 2003;37:47–57.
24. Resnick N, Yahav H, Shay-Salit A et al. Fluid shear stress and the vascular endothelium: for better and for worse. Prog Biophys Mol Biol 2003;81:177–99.
25. Stepp DW, Nishikawa Y, Chilian WM. Regulation of shear stress in the canine coronary microcirculation. Circulation 1999;100:1555–61.
26. Normann NA, Kennedy JH. Arterial baroreceptor responses to intra-aortic balloon assistance. J Surg Res 1971;11:396–400.
27. Wahl M, Schilling L. Regulation of cerebral blood flow–a brief review. Acta Neurochir Suppl (Wien) 1993;59:3–10.
