- 🚛 В наличии на складе
-
COVID-19
- Средства индивидуальной защиты
- Кабина дезинфекции
- Ультрафиолетовый облучатель
- Термометр медицинский
- Измеритель АД
- Аппараты ИВЛ
- Увлажнитель кислорода
- Монитор пациента
- Шприцевой насос
- Аспиратор электрический
- Анализатор газов в крови
- Спирометр Пульсоксиметр
- Реабилитация лёгочной дисфункции пациентов, перенёсших Covid-19.
- Аппараты НИВЛ
- Диагностика
- Физиотерапия
- Криотерапия
- Контрпульсация (УНКП)
- Литотриптеры
-
Тепло и грязелечение
- Автоматизированные кухни для Теплолечения
- Система с подогревом для релаксации и грязевых аппликаций Aqua-Relax
- Система для релаксации с нагретым песком Sand Relax
- Инфракрасный теплоизлучатель Theramed 4
- Автоматизированные кухни для Грязелечения
- Мини−кухни для Применения Пакетированных Грязевых Аппликаций
- Системы для Обертываний «Velvet»
- Система пелоидотерапии конечностей
- Одноразовые грязевые аппликации
- Косметология
- Активное долголетие
- Хирургия
- Ветеринария
-
Реабилитация
- Тренажер с универсальной нагрузкой EN-Tree Pulley MDD
- Подвес реабилитационный «Орторент М»
- Аппарат для механотерапии «ОРТОРЕНТ» модель «Актив»
- Аппарат двигательный «Орторент-лучезапястный»
- Тренажер «Орторент Carmina»
- Электростимулятор Cefar Rehab X2
- Система электротерапии VitalStimPlus
- Беговая дорожка детская с БОС «Орторент»
Усиленная наружная контрпульсация при сердечной недостаточности: дизайн исследования «Перспективная оценка влияния УНКП при сердечной недостаточности» (PEECH)
Arthur M. Feldman, Md, Phd,1 Marc A. Silver, Md,2 Gary S. Francis, Md,3 Paul-andre De Lame, Md,4 and William W. Parmley, Md 5
Philadelphia, Pennsylvania; Oak Lawn, Illinois; Cleveland, Ohio; Stockton, New Jersey; San Francisco, California
Резюме
Исходные данные: Усиленная наружная контрпульсация (УНКП) может улучшить переносимость физических нагрузок у пациентов с ИБС; однако, возможное влияние УНКП на пациентов с сердечной недостаточностью (ХСН) и дисфункцией левого желудочка (ДЛЖ) остается неясным. Открытое пилотное исследование показало значительное увеличение времени переносимости нагрузки у пациентов с ХСН, прошедших курс УНКП. Основываясь на этом, было выполнено крупномасштабное, контролируемое исследование у больных со стабильной ХСН (II - III ФК по классификации NYHA и ДЛЖ.
Методы и результаты: Исследование PEECH является контролируемым, рандромизированным, слепым, с параллельной группой сравнения, многоцентровым
исследованием в которое включено 187 пациентов с симптоматической, но стабильной ХСН (NYHA II – III ФК) и ФВ ЛЖ < 35% и было спланировано для оценки влияния УНКП на пациентов со стабильной ХСН. Медикаментозное лечение было оптимизировано для всех пациентов на основании рекомендаций Американского общества специалистов по сердечной недостаточности (Heart Failure Society of America) (“Usual Care” – стандартное лечение (UC), а затем больные были рандомизированы в две группы лечения; UC или УНКП (35 часов в течение 7 недель).
Выводы: эффективность определяли по стандартному тредмилл - тесту (по модифицированному протоколу Naughton), с измерением пика поглощения кислорода и продолжительности нагрузки; анкетам о качестве жизни, классификации ХСН по NYHA и нейрогормональным маркерам ХСН.
Ключевые слова: Усиленная наружная контрпульсация, сердечная недостаточность, клиническое исследование.
Сердечная недостаточность приобрела масштабы эпидемии в Соединенных Штатах, затрагивая более 5 миллионов пациентов и приводя к почти 500000 смертям ежегодно.1 Хотя стандартные методы лечения значительно снизили годовую смертность и уровень госпитализаций, это заболевание все равно ассоциируется с высоким уровнем заболеваемости и смертности.1
В последнее время усиленная наружная контрпульсация (УНКП) улучшила переносимость нагрузок у пациентов со стенокардией и нормальной функцией левого желудочка.2 Однако, регистр добровольцев, включающий более 5000 человек, дает основания для предположения, что УНКП может также помочь пациентам с нарушением функции левого желудочка.3 Более того, небольшое пилотное исследование больных с сердечной недостаточностью, вызванной как ишемической, так и неишемической дилатационной кардиомиопатией, продемонстрировало улучшение переносимости нагрузки, качества жизни и функционального статуса больных с незначительными побочными эффектами.4 Таким образом, чтобы проверить эффективность данного инновационного метода лечения, было спланировано исследования PEECH (Перспективная оценка применения УНКП при застойной сердечной недостаточности) – слепое, рандомизированное (по методу случайной выборки), контролируемое клиническое исследование.
Данная статья описывает дизайн исследования и обсуждает его методологию.
Схема исследования
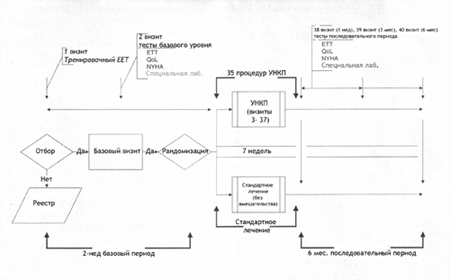
Исследование PEECH спланировано для того, чтобы оценить УНКП как средство дополнения к стандартным одобренным медикаментозным методам лечения. Это слепое, рандомизированное, контролируемое, многоцентровое клиническое исследование в которое включали пациентов с симптоматической ХСН (от слабой до умеренной) II-III ФК NYHA и ФВ ЛЖ ≤ 35%. Субъекты исследования должны быть клинически стабильными, с минимальным или отсутствием признаков отеков, и, перед регистрацией, должны проходить лечение сердечной недостаточности в соответствии с практическим руководством Американского общества
специалистов по сердечной недостаточности.5 До включения все кандидаты должны принимать ингибиторы АПФ и бета-адреноблокаторы как минимум в течение 1 и 3 месяцев, соответственно, если они не притивопоказаны. Соответствующие критериям пациенты рандомизируются в соотношении один к одному на УНКП (активная группа) и «стандартное лечение» (UC) (т.е., продолжение исходного лечения). Пациентов обследуют через 1 неделю, 3 и 6 месяцев после
лечения в группе УНКП. Пациентов из группы UC посещают в те же временные промежутки, через 8 недель после рандомизации, чтобы все больные прошли по одной временной шкале рис. 1.
Исследование PEECH проводится в соответствии с Хельсинской декларацией и соответствующими правилами. Все субъекты подписывали согласие на участием в любых процедурах исследования.
Процедуры исследования
Критерии включения обобщены в табл. 1.
| Критерии включения |
| Сердечная недостаточность вследствие ИБС или идиопатической ДКМП, с ФВ ЛЖ ≤ 35%, определенной в течение 3 месяцев до включения. |
| II-III ФК ХСН по NYHA. |
| Способность переносить нагрузки в течение 3 минут и более, при этом нагрузка может быть ограничена только симптомами ХСН. |
| Клинически стабильное состояние, определяемое по отсутствию изменений в приеме лекарств, назначенных по поводу сердечной недостаточности в течение 2 недель до рандомизации. |
| Отек менее чем 1+, не более чем отек ступни/лодыжки |
| Если используется, уровень дигоксина ≤ 1.75 нанограмм/мл. |
| Креатинина сыворотки крови ≤ 2.5 мг/dl. |
| Лечение ингибитороми АПФ в течение месяца и более до |
| Лечение стабильной дозой бета-адреноблокаторов в течение 3 месяцев и более до регистрации |
| Критерии исключения |
| Острый коронарный синдром меньше 6 недель до регистрации |
| Не шунтированный ствол ЛКА со стенозом ≥ 50%. |
| АКШ < 3 месяцев, PCI< 6 месяцев до регистрации. |
| Катетеризация сердца < 2 недель до регистрации. |
| Аритмия, которая может значительно повлиять на инициацию устройства УНКП. |
| ХОБЛ с объемом форсированного выдоха на 1-1-й секунде (FEV1) ≤1.5 л. |
| Клинически значимый порок сердца, острый миокардит. |
| ICD, если начиналось менее чем за 3 месяца до регистрации. |
| Тромбоз глубоких вен, трофические язвы и/или легочные эмболии, аневризм аорты. МНО ≥ 2.5. |
| Неконтролируемая гипертензия (САД ≥180 mmHg, ДАД ≥110 mmHg). |
| Любое медицинское, физиологическое, сознательное, социальное или юридическое условие, которое может помешать пациенту дать письменное согласие, или соответствовать требованиям исследования, в том числе необходимые временные обязательства. |
| Участие в любом клиническом интервенционном исследовании за последние 30 дней. |
| Беременные женщины, или женщины, фертильного возраста и не применяющие методы контрацепции. |
| Запрещенные препараты |
| При идиопатической кардиомиопатии: блокаторы кальциевых каналов |
| При ишемической кардиомиопатии: блокаторы кальциевых каналов, если прием начат < 1 месяца или прекращен < 3 месяцев до регистрации, бета - адреноблокаторы, если прием начат или прекращен <3 месяцев до регистрации |
| Текущее или предстоящее лечение вводимыми инотропными веществами, в том числе добутамин |
Назначение лечения
Отвечающие критериям включения больные рандомизированы координационным центром. Субъекты стратифицированы по этиологии сердечной недостаточности (ишемической или идиопатической), возрасту, полу, лечению ингибитором АПФ или блокатором АТ рецепторов, и лечением бета-адреноблокатором. Субъектам был назначен 35-часовой курс УНКП (35 процедур по 1 часу в течение 7-8 недель). При УНКП использовали три пары пневматических манжет, наложенных вокруг нижних конечностей и ягодиц. Манжеты надували последовательно вверх с началом диастолы, и во всех быстро стравливали давление в начале систолы. Определенное протоколом прилагаемое давление составляло 300 мм рт. ст., его достигали в течение 5 минут с начала сеанса. Постоянно в течение процедуры регистрируется пульсоксиметрия, и если насыщение крови кислородом падает на 4 % и более, оценивается клиническое состояние субъекта вновь. Лечение продолжали, если исследователь находил состояние пациента удовлетворительным. Субъекты, которым назначено UC, были проинструктированы сообщать исследовательскому персоналу о своем состоянии в любое время; им был назначен первый визит через 8 недель после рандомизации.
Тест на переносимость физических нагрузок
Тест на переносимость физических нагрузок является стандартным для всех принимающих участие в исследовании центров: необходимо успешно провести 2 квалификационных теста до регистрации пациентов. Субъекты проходят тестирование по модифицированному протоколу Naughton на стандартном, калиброванном тренажере «бегущая дорожка» с возможностью регистрации показателей деятельности сердца и легких.
12-канальная ЭКГ и основные показатели состояния организма регистрировали во время тредмилл-теста, постоянно измеряли поглощение кислорода. Кислород тестировали вдох–завдохом, затем измеряли пиковое поглощение кислорода. Пиковое поглощение кислорода (peak VO2 ) определяли как потребление кислорода при максимальном уровне нагрузки, который может достигнуть данный субъект. Устанавливали критерии, для того, чтобы убедиться, что тест на нагрузку показал максимальную способность каждого субъекта, в том числе коэффициент дыхания > 1, по шкале Борга (Borg scale) 14 или более (по шкале от 6 до 20), и наблюдение анаэробного порога перед завершением упражнения. Анализы данных выполняли в центральной лаборатории.
Другие параметры
Качество жизни оценивали с помощью анкет SF-366 и «Жизнь с сердечной недостаточностью, Миннесота (Minnesota Living With Heart Failure)7. Классификация NYHA оценивалась «вслепую» исследователем, который также врачебный осмотр при каждом визите (исходном и последующем). Подсчитываются изменения в приеме лекарств и побочные эффекты. Побочные эффекты, определенные как результаты исследования PEECH, включая ухудшение сердечной недостаточности, острые коронарные синдромы, инсульт, реанимацию после внезапной смерти и смерть, оценивались комитетом по анализу конечных клинических точек. Лабораторные тесты выбранных маркеров и стандартной безопасности проводили исходно, через 1 неделю и через 6 месяцев после лечения.
Слепой метод
Члены персонала, ответственные за оценку субъектов исследования исходно и при последующих визитах «ослеплены» в отношении назначенного лечебного режима, как и различные центральные лаборатории. Каждое учреждение, принимающее участие в исследовании, обязано назначить исследователя «вслепую» до начала исследования. Файлы исследования также организованы таким образом, чтобы сохранить «ослепление». Другой персонал, в том числе координаторы исследования, определен как «открытые исследователи». Координаторы исследования контролируют соответствие процедурам исследования, в том числе «слепому» методу. Открытые исследователи отвечают за диспансеризацию до и после лечения, за оценку побочных эффектов, за предоставление необходимой медицинской помощи. Между «ослепленным» персоналом и субъектами исследования не должно происходить прямого контакта за пределами процесса оценки. Центральные лаборатории, в частности центральная лаборатория по оценке физических нагрузок, не имеют информации об учреждении, субъекте, очередности тестов на нагрузку. Субъекты, которым назначена УНКП, наблюдаются ежедневно во время периода лечения, в отличие от тех, кто проходит UC. Чтобы исключить влияние этого фактора на интерпретируемость результатов исследования, и убедиться, что все субъекты исследования в смысле получения медицинской помощи равнозначны, координаторы исследования воздерживаются от добровольных медицинских советов пациентам в группе УНКП. Координаторы исследования также еженедельно связываются с пациентами группы UC, чтобы дать им возможность рассказать о своем состоянии и поддерживать связь с персоналом исследования. Пациенты также проинформированы о том, что нельзя давать информацию исследователю о их принадлежности к группе.
Статистика
Первичной временной точкой для проведения анализа будут 6 месяцев. Вторичный анализ будет проводиться, чтобы оценить изменения по сравнению с исходным уровнем через 1 неделю и через 3 месяца после завершения процедур. Все статистические тесты будут двусторонние с уровнем значимости 0.05, если не утверждается иного.
Параметры эффективности
Параметры эффективности включают процент субъектов с увеличением пикового VO2 по крайней мере на 1.25 мл/мин/кг, и процент субъектов с увеличением продолжительности переносимых нагрузок по крайней мере на 60 секунд, по сравнению с исходным уровнем. Вторичные параметры состоят из изменения пикового VO2, продолжительности переносимых нагрузок, субмаксимальных параметров физической нагрузки, по шкале качества жизни и класса NYHA, циркулирующих маркеров, выбранных сердечно-сосудистых лекарствах и в частоте
сердечно-сосудистых приступов.
Аналитические методы
Для анализа эффективности первичная популяция будет популяцией пациентов, которых намеревались лечить. Вторичный анализ будет проведен на популяции, занесенной в протокол. Пациенты, выпавшие из исследования будут рассматриваться двояко. Первичный анализ будет проведен на данных, перенесенных со всех последующих визитов (анализ перенесенного последнего смотра). Вторичный анализ не заменит недостающих данных (анализ наблюдаемого дела).
Для качественных переменных параметры эффективности будут анализироваться с помощью критерия Cochran-Mantel-Haenszel, выверенного для исследователя. Непрерывные переменные будут анализироваться с помощью дисперсионного анализа, где лечение – главный эффект, а исследователь – коэффициент блокировки. Лечение по взаимодействию с исследователем будет проверяться на уровне значимости 0.1, и, если обнаружится, что оно значимо, то природа взаимодействия будет изучаться далее. Если окажется, что предположения об однородности дисперсии или нормальности не подтвердятся, вместо дисперсионного анализа будут использоваться непараметрические критерии. Сравнения лечения по двум основным параметрам (пиковый VO2 и продолжительность нагрузки) будут производиться по закрытому методу испытания Hochberg, с контролем суммарной погрешности типа один на 0,05. Вторичный анализ с использованием глобального метода проверки O’Brien будет произведен на изменениях по сравнению с исходным уровнем пикового VO2, продолжительности нагрузки и качества жизни (по итоговым показателям по SF-36 и «Minnesota Living With Heart Failure»).
Численность выборки и сила результатов
Численность выборки составляет 72 пациента в группе, что позволит дать 90% мощность результатов для статистически значимой разницы при уровне значимости 0.025, предполагая что 60% субъектов, проходящих лечение УНКП достигнут увеличение пикового VO2 по крайней мере на 1.25 мл/мин/кг по сравнению с 30% пациентов UC. Такая численность выборки дает 90% силы для определения статистически значимой разницы между EECP и UC в увеличении
продолжительности нагрузки, предполагая, что 50% пациентов УНКП достигнут увеличение продолжительности нагрузки, по крайней мере, на 60 секунд, по сравнению с 20% пациентов UC. Рассчитывая на уровень отсева 20%, в группу будет зарегистрировано около 90 пациентов.
Организация исследования
Управляющий комитет наблюдает за общим направлением исследования и управляет проектом с клинической и научной точки зрения. Координационный центр обеспечивает ежедневное наблюдение за всеми аспектами этого многоцентрового исследования, в том числе за процессом рандомизации, сбора и обработки данных, контролем учреждений. Централизованные лаборатории используются для тестирования на нагрузку, лабораторных тестов безопасности и циркуляционных маркеров. Контрольная комиссия по безопасности данных наблюдает за всеми аспектами безопасности исследования. В случае появления побочных эффектов, которые исследователь считает серьезными, комиссия должна быть уведомлена немедленно. Комиссия в этом случае может порекомендовать внести изменения в протокол или прекратить лечение отдельных пациентов, и она устанавливает правила, согласно которым исследование может быть прекращено из соображений безопасности. Независимый комитет по клиническим результатам Комитет по анализу конечных клинических результатов классифицирует информацию о побочных эффектах в клинические исходы, и эта классификация уже просматривается контролером клиники перед тем, как быть внесенной в базу данных.
Дискуссия
При разработке исследования PEECH было важно решить, какова будет подходящая стратегия лечения для пациентов контрольной группы. В более ранних исследованиях УНКП при лечении пациентов с ИБС (например, MUST-EECP),2 “контрольные” пациенты получали фиктивное лечение УНКП («фиктивное» здесь – условно оптимальная контрпульсация с прилагаемым давлением в 75 мм рт.ст., что недостаточно для снижения постнагрузки). Однако, полагалось, что фиктивная УНКП была противопоказана пациентам с сердечной недостаточностью.
Во-первых, из-за того, что фиктивная УНКП повышала венозный возврат в правые отделы сердца без сопутствующего снижения постнагрузки, имелся потенциальный риск возникновения имптомов сердечной недостаточности правых отделов сердца или легочного отека.
Во-вторых, из-за большей осведомленности пациентов о процедуре УНКП и доступности информации для общества на соответствующих веб-сайтах, пациенты, скорее всего, смогли бы распознать, получают ли они полноценную терапию, или фиктивную. И, наконец, исследования предположили, что даже надувание под невысоким давлением может вызвать изменения в сосудистой функции и активизации тромбоцитов, приводя тем самым к некоторым благотворным результатам при условно оптимальном уровне надувания. В результате этих открытий, в качестве контрольной группы стали использовать группу с UC. Однако данный подход требует тщательного «ослепления» группы исследователей.
Проблема, созданная выбором группы UC в качестве контрольной популяции для исследования PEECH, подняла массу вопросов, сходных с теми, которые возникли при планировании недавних исследований, оценивающих эффективность устройств для пациентов с сердечной недостаточностью, в том числе ресинхронизирующую терапию и имплантируемые сердечные дефибрилляторы.8
Однако, в отличие от исследований, оценивающих эффективность имплантируемых устройств, мы «ослепили» исследователей на предмет рандомизации по лечению каждого пациента, отделив клиническую группу, которая обеспечивала утвержденную протоколом оценку исследования, от группы врачей, предоставляющих ежедневную медицинскую помощь пациентам. Сделать это было намного сложнее с пациентами, получавшими лечение с помощью устройств, так как у каждого пациента имелся характерный хирургический шрам. В многоцентровых исследованиях устройств, первичным предполагаемым клиническим результатом были смертность и госпитализация – объективные результаты, на которые не могли оказать влияние врачиисследователи. В отличие от этого, результаты исследования PEECH требовали вклада врачей или могли подвергнуться воздействию неустранимого смещения из-за вмешательства персонала исследования во время теста на нагрузку, поэтому необходим был более выгодный протокол «ослепления». Однако, схема исследования не может гарантировать, что пациенты не будут информировать исследователя об их принадлежности к группе; или частые визиты к врачу могут вызвать эффект плацебо: оба эти факта могут повлиять на результаты исследования. Следовательно, мы с большой осторожностью будем интерпретировать данные исследования. К тому же, чтобы предотвратить возможные отклонения, мы будем осторожно оценивать вторичные клиническими результатами как часть общей оценки данного исследования. Вторичные результаты будут включать изменения в медицинском лечении и в проявлении нейрогормональных маркеров, таким образом давая нам объективные данные, на которые не должен влиять эффект плацебо – особенно за последовательный период в 6 мес.
И последнее, о чем мы беспокоились, это то, что пациенты, не проходящие лечение УНКП, казалось бы не получали никаких результатов из-за участия в PEECH. Однако, мы тщательно проверяли каждого пациента до регистрации на предмет, того, что его/ее лечение было оптимизировано (т.е. они получали все рекомендованные руководством препараты для лечения больных с хронической сердечной недостаточностью).5 Более того, каждый пациент группы UC
часто посещал врача, и с ним/ней регулярно связывалась медицинская сестра (эти стратегии ведения пациентов обнаружили значительное положительное воздействие на пациентов с сердечной недостаточностью). Таким образом, пациенты, зарегистрированные в группу UC, получали такую медицинскую помощь, которая объективно лучше чем та, которую они получали вне исследования.
Таким образом, PEECH – это многоцентровое, рандомизированное, слепое, контролируемое исследование, оценивающее влияние УНКП в качестве вспомогательного метода лечения пациентов с сердечной недостаточностью, в результате ИБС или ДКМП. PEECH было спланировано для обеспечения независимой оценки эффективности УНКП в улучшения качества жизни группы пациентов с слабыми и умеренными симптомами сердечной недостаточности,
появляющимися, несмотря, на оптимальное медицинское лечение. Важные составные элементы исследования PEECH включают: рандомизацию, применение объективных первичных результатов «ослепление» врачей исследователей, независимость и «ослепление» центральных лабораторий, строгий отбор субъектов по критериям, и оптимизация UC.
Список литературы
1. American Heart Association. Heart disease and stroke statistics—2004 update. Dallas (TX): American Heart Association; 2003.
2. Arora RR, Chou TM, Jain D, Fleishman B, Crawford L, McKiernan T, et al. The multicenter study of enhanced external counterpulsation (MUST-EECP): effect of EECP on exercise-induced myocardial ischemia and anginal episodes. J Am Coll Cardiol 1999;33:1833–40.
3. Soran O, Kennard ED, Kelsey SF,Holubkov R, Strobeck J, Feldman AM. Enhanced external counterpulsation as treatment for chronic angina in patients with left ventricular dysfunction: a report from the International EECP Patient Registry (IEPR). Congest Heart Fail 2002;8: 297–302.
4. Soran O, Fleishman B, Demarco T, Grossman W, Schneider VM, Manzo K, et al. Enhanced external counterpulsation in patients with heart failure: a multicenter feasibility study. Congest Heart Fail 2002;8:204–8.
5. Heart Failure Society of America (HFSA). HFSA practice guidelines: HFSA guidelines for management of patients with heart failure caused by left ventricular systolic dysfunction— pharmacological approaches. J Card Fail 1999;5:357–62.
6. Ware JE. SF-36 health survey: manual and interpretation guide. Boston (MA): Nimrod Press; 1993.
7. Rector TS, Cohn JN. Assessment of patient outcome with the Minnesota Living with Heart Failure questionnaire: Reliability and validity during a randomized, double-blind, placebo-controlled trial of pimobendan. Pimobendan Multicenter Research Group. Am Heart J 1992;124: 1017–25.
8. Bristow MR, Feldman AM, Saxon LA, for the COMPANION Steering Committee and COMPANION Clinical Investigators. Heart failure management using implantable devices for ventricular resynchronization: Comparison of Medical Therapy, Pacing, and Defibrillation in Chronic Heart Failure (COMPANION) trial. J Card Fail 2000;6:276–85.
