- 🚛 В наличии на складе
-
COVID-19
- Средства индивидуальной защиты
- Кабина дезинфекции
- Ультрафиолетовый облучатель
- Термометр медицинский
- Измеритель АД
- Аппараты ИВЛ
- Увлажнитель кислорода
- Монитор пациента
- Шприцевой насос
- Аспиратор электрический
- Анализатор газов в крови
- Спирометр Пульсоксиметр
- Реабилитация лёгочной дисфункции пациентов, перенёсших Covid-19.
- Аппараты НИВЛ
- Диагностика
- Физиотерапия
- Криотерапия
- Контрпульсация (УНКП)
- Литотриптеры
-
Тепло и грязелечение
- Автоматизированные кухни для Теплолечения
- Система с подогревом для релаксации и грязевых аппликаций Aqua-Relax
- Система для релаксации с нагретым песком Sand Relax
- Инфракрасный теплоизлучатель Theramed 4
- Автоматизированные кухни для Грязелечения
- Мини−кухни для Применения Пакетированных Грязевых Аппликаций
- Системы для Обертываний «Velvet»
- Система пелоидотерапии конечностей
- Одноразовые грязевые аппликации
- Косметология
- Активное долголетие
- Хирургия
- Ветеринария
-
Реабилитация
- Тренажер с универсальной нагрузкой EN-Tree Pulley MDD
- Подвес реабилитационный «Орторент М»
- Аппарат для механотерапии «ОРТОРЕНТ» модель «Актив»
- Аппарат двигательный «Орторент-лучезапястный»
- Тренажер «Орторент Carmina»
- Электростимулятор Cefar Rehab X2
- Система электротерапии VitalStimPlus
- Беговая дорожка детская с БОС «Орторент»
Влияние усиленной наружной контрпульсации на провоспалительные цитокины и молекулы адгезии у пациентов со стенокардией и ангиографически доказанной коронарной болезнью сердца
Darren P. Casey, PhDa,*, C. Richard Conti, MDb, Wilmer W. Nichols, PhDb, Calvin Y. Choi, MDb, Matheen A. Khuddus, MDb, and Randy W. Braith, PhDa
Сердечно-сосудистые заболевания ассоциируются с хроническим low-grade воспалением, что подтверждается повышенным уровнем циркулирующих провоспалительных цитокинов. Экспериментальные данные подтверждают, что воспаление может быть подавлено в условиях высокого напряжения сдвига. Целью исследования было изучить влияние усиленной наружной контрпульсации (УНКП), неинвазивной терапии, которая увеличивает напряжение сдвига на эндотелии, на содержание циркулирующих биомаркеров воспаления и молекул адгезии у пациентов со стенокардией. Двадцати одному пациенту случайным образом назначен курс 35 одночасовых процедур с давлением в манжетах 300 mm Hg (УНКП; n = 12) или 75 mm Hg (слепой; n = 9). Содержание фактора некроза опухоли α в плазме крови, белка хемоаттрактанта моноцитов 1, растворимой молекулы сосудистой адгезии 1 было определено до и после 35 истинных или ложных одночасовых процедур. У пациентов в группе УНКП наблюдалось уменьшение уровня фактора некроза опухоли α (6.9 ±2.7 против 4.9 ±2.5 pg/ml, p <0.01; -29%) и белка хемоаттрактанта моноцитов 1 (254.9±55.9 против 190.4 ± 47.6 pg/ml, p <0.01; -19%) после курса лечения, в то время как в режиме эмитации изменений обнаружено не было. Изменений в содержании растворимой молекулы сосудистой клеточной адгезии 1 обнаружены не были ни в одной из групп. В заключение, важно отметить, что 35 процедур УНКП снизили уровни циркулирующих провоспалительных биомаркеров у пациентов с симптоматичной коронарной болезнью сердца.
У больных с коронарной болезнью сердца наблюдается повышение уровней провоспалительных цитокинов и молекул адгезии по сравнению с соответствующими значениями у здоровых. Более того, уровни провоспалительных цитокинов повышаются еще больше у пациентов со стенокардией. Усиленная наружная контрпульсация (УНКП) является неинвазивным способом лечения больных с симптоматической коронарной болезнью сердца. Также продемонстрировано уменьшение рефрактерной стенокардии под влиянием этого метода лечения. УНКП значительно увеличивает диастолический кровоток и напряжение сдвига в центральных и периферических сосудистых ложах. В экспериментах доказано, что высокое напряжение сдвига оказывает благоприятное влияние на провоспалительные цитокины и молекулы адгезии. Таким образом, мы предположили, что высокие уровни напряжения сдвига, вызванные УНКП, снижают циркулирующие уровни отдельных провоспалительных маркеров и адгезивных молекул у больных со стенокардией.
Результаты и методы
Данное проспективное, одиночное «слепое», исследование с использованием режима симуляции включало 21 пациента со стенокардией, которым была назначена УНКП. Все испытуемые были набраны из Кардиологической клиники больницы Шэндс Университета Флориды во время клинического осмотра, проводимой кардиологом и являющейся обязательной для всех пациентов, кому назначается УНКП. Исследование было одобрено Контрольной комиссией медицинского центра Университета Флориды и у всех пациентов получено письменное согласие. Критериями включения были: возраст ≥ 21 года, симптомы стенокардии или эквиваленты в среднем 2 и более раз в неделю, ангиографически подтвержденное поражение 1 и более эпикардиальных коронарных артерий. Критериями исключения были нестабильная стенокардия, аритмия, способная помешать работе УНКП, сердечная недостаточность и/или фракция выброса левого желудочка меньшая или равная 30%, поражение клапанов сердца, тяжелое поражение периферических сосудов или неконтролируемая гипертензия (>180/100 mm Hg). Больным случайным образом назначался курс из 35 одночасовых процедур УНКП с давлением в манжетах равным 300 mm Hg (УНКП; n = 12) или курс процедур в режиме симуляции УНКП с давлением в манжетах равным 75 mm Hg (режим симуляции; n = 9). Курс УНКП проходил в больнице Шэндс Университета Флориды в Гэйнсвилле. Пациенты проходили процедуры длительностью 1 час в день с понедельника по пятницу семь недель подряд, что в общей сложности составило 35 часов терапии. УНКП представляла собой последовательную инфляцию и дефляцию манжет, закрепленных на икрах, нижних и верхних частях бедер пациента. Давление воздуха в манжетах применялось к нижним конечностям пациента в последовательности.
Таблица 1.
| Исходные характеристики пациентов | ||
| Переменная | УНКП (n=12) | Режим симуляции (n=9) |
| Возраст (лет) | 63± 11 | 62± 10 |
| Мужчины/Женщины | 8/4 | 7/2 |
| Индекс массы тела (кг/м2) | 29.8 ± 3.4 | 33.0 ± 4.2 |
| Общий холестерол (мг/дл) | 138±41 | 142 ± 25 |
| Липопротеины низкой плотности (мг/дл) | 68 ± 37 | 72 ± 22 |
| Липопротеины высокой плотности (мг/дл) | 45 ± 15 | 33 ± 7 |
| Триглицериды (мг/дл) | 123 ± 10 | 165 ± 76 |
| Глюкоза (мг/дл) | 116 ± 22 | 107 ± 16 |
| Предшествующие инфаркты миокарда | 4 | 3 |
| Многососудистое поражение | 10 | 8 |
| Предшествующее чрескожное коронарное вмешательство | 8 | 7 |
| Предшествующее аортокоронарное шунтирование | 7 | 5 |
| Диабет | 6 | 4 |
| Гипертензия | 9 | 6 |
| Гиперлипидемия | 10 | 8 |
Данные представлены как средняя ±SD.
Синхронизированной с сердечным циклом с помощью обработанных микропроцессором сигналов ЭКГ. Диастолическое аугментационное давление постепенно увеличивали путем усиления внешнего давления до 300 mm Hg (УНКП) или 75 mm Hg (режим симуляции). Пациентам было предписано продолжать принимать их обычные лекарства. До и после завершения исследования был определен класс стенокардии по классификации канадского общества кардиологов.
Пробы венозной крови были взяты до и после 35 часов УНКП или терапии в режиме симуляции. Уровни α-фактора некроза опухоли (TNF-α), хемоаттрактанта моноцитов протеина 1 (MCP1) и растворимой сосудистой молекулы клеточной адгезии 1 (sVCAM-1) в плазме крови были определены с помощью имеющегося в продаже иммуносорбентного анализа с применением фиксированных ферментов (Quantikine; R&D Systems Inc., Minneapolis, Minnesota). Эти маркеры были выбраны на основе предшествующих экспериментальных результатов. Между- и внутритестовые коэффициенты вариации составляли 4.6% и 7.7% для TNF-α, 4.2% и 6.9% для MCP-1, 3.4% и 6.1% для sVCAM-1 соответственно. Уровни глюкозы и липидов сыворотки крови были измерены в лабораториях больницы стандартными и одобренными способами.
Анализ вариант использовали для анализа исходных межгрупповых различий. Изменение в зависимых постоянных переменных определяли анализом повторных измерений до и после сеансов УНКП. Когда обнаруживали значительная group-by-time взаимосвязь, внутригрупповые сравнения временных точек и межгрупповые сравнения по каждой временной точке были выполнены с помощью post hoc анализа Тьюки. Все статистические исследования были проведены с использованием SPSS версии 15.0 для Windows (SPSS, Inc., Chicago, Illinois). Все данные представлены как средняя ± SD. Для статистической значимости был необходим α-уровень p<0.05.
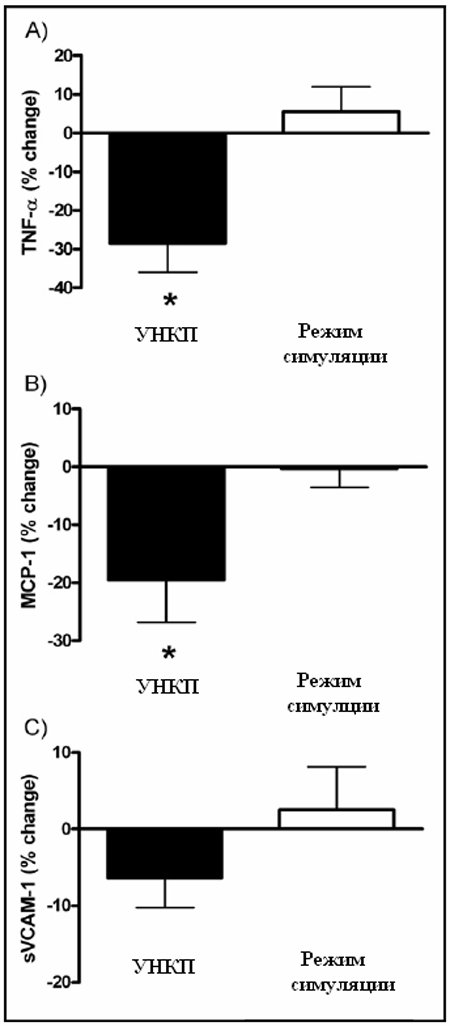
Исходные характеристики представлены в таблице 1. К началу исследования между двумя группами не выявлено различий в отношении АД, лекарственной терапии, факторов риска, предшествующего сердечно-сосудистого анамнеза и/или процедур. После вмешательства у больных получивших курс УНКП, выявлено улучшение в ФК стенокардии по Канадской классификации (3.1 ± 0.5 против 1.2 ± 0.4, p <0.01), уменьшение количества приступов стенокардии (1.6 ± 1.4 против 0.4 ± 0.6, p<0.05) и частоты использования нитроглицерина в день (0.5 ± 0.7 против 0.1 ± 0.2, p <0.05). В группе симуляции не наблюдалось никаких изменений ни по одному из критериев. После 35 часов лечения, уровни TNF-α (6.9 ±2.7 против 4.9 ± 2.5 pg/ml, p<0.01) и MCP-1 (255 ± 56 против 190 ± 48 пг/мл, p<0.01) в группе УНКП были снижены, и остались без изменений в группе режима симуляции (6.4 ±1.9 против 6.7 ± 1.9 пг/мл, p = 0.54, и 270 ± 82 против 264 ± 66 пг/мл, p = 0.51 соответственно). Изменений sVCAM-1 не обнаружено ни в группе УНКП (776 ± 280 против 726± 278 нг/мл, p = 0.14), ни в группе симуляции (847± 177 против 859± 160 нг/мл, p = 0.81)(Рис. 1).
Обсуждение
Это первое рандомизированное исследование влияния УНКП на воспаление и уровень адгезивных молекул у больных рефрактерной стенокардией. Наши данные показывают, что УНКП оказывает противовоспалительный эффект у больных со стенокардией. Степень снижения TNF-α (-29%), наблюдавшееся в данном исследовании, после курса УНКП, соответствует влиянию ранее изученных вмешательств, таких как физическая нагрузка у больных с сердечнососудистыми заболеваниями. УНКП также эффективна в снижении уровня MCP-1 в плазме крови. Высокие уровни TNF-α и MCP-1 в плазме крови являются предикторами будущих неблагоприятных событий. Таким образом, наблюдаемое в данном исследовании снижение воспаления может иметь клиническое значение для снижения риска развития неблагоприятных событий у данной группы больных.
Механизм, отвечающий за противовоспалительное влияние УНКП, вероятно, связано с временным повышением напряжения сдвига, вызванным каждым инфляционно-дефляционным циклом манжет. Напряжение сдвига является сильным стимулом синтеза и выделения эндотелиального оксида азота. Кроме того, что оксид азота сильный вазодилататор, он также оказывает противоспалительное и антиатеросклеротическое влияние, ингибируя экспрессию MCP-1 и экспрессию VCAM-1. Более того, в зонах с низким напряжением сдвига наблюдается снижение биодоступности оксида азота и повышенная регуляция (upregulation) провоспалительных биомаркеров. Хотя продукцию оксида азота не изучали в настоящем исследовании, ранее было продемонстрировано, что УНКП приводит к повышению уровней нитратов в плазме крови, что является маркером продукции оксида азота. Снижение содержания TNF-α после УНКП возможно оказывает влияние на снижения уровня MCP-1 в плазме крови. Чиу и соавт. (Chiu et ali) показали, что клетки эндотелия, подвергающиеся высокому напряжению сдвига, ослабляют выделение MCP-1, вызванное TNF-α. Хотя мы не обнаружили значительных изменений в уровнях sVCAM-1 после УНКП, используя иммуносорбентный анализ с применением фиксированных ферментов, вероятно, что мембранносвязанные уровни VCAM-1 могут меняться в ответ на УНКП. К сожалению, рамки данного исследования не позволили изучить мембранносвязанные VCAM-1.
Рис. 1. (A) Процент изменения TNF-α после 35 сеансов; (B) Процент изменения MCP-1 после 35 сеансов; (C) Процент изменения sVCAM-1 после 35 сеансов. *p<0.05 против значений до курса лечения. Данные выражены как средняя ± SEM.
Заключение
Результаты данного исследования демонстрируют, что УНКП является эффективным способом вмешательства для снижения уровней TNF-α и MCP-1 в плазме крови, которое происходит параллельно уменьшению симптомов стенокардии. Вместе взятые результаты говорят о том, что противовоспалительный эффект может помочь объяснить механизм уменьшения симптомов после сеансов УНКП. Для подтверждения наших выводов необходимы исследования, включающие больший размер пробных образцов и других биомаркеров воспаления.
Список литературы:
1. Ikonomidis I, Andreotti F, Economou E, Stefanadis C, Toutouzas P, Nihoyannopoulos P. Increased proinflammatory cytokines in patients with chronic stable angina and their reduction by aspirin. Circulation 1999;100:793–798.
2. Mizia-Stec K, Mandecki T, Zahorska-Markiewicz B, Janowska J, Szulc A, Jastrzebska-Maj E, Szymanski L, Majewski T. Selected cytokines and soluble forms of cytokine receptors in coronary artery disease. Eur J Intern Med 2002;13:115–122.
3. Aukrust P, Berge RK, Ueland T, Aaser E, Damas JK, Wikeby L, Brunsvig A, Muller F, Forfang K, Froland SS, Gullestad L. Interaction between chemokines and oxidative stress: possible pathogenic role in acute coronary syndromes. J Am Coll Cardiol 2001;37:485– 491.
4. Nichols WW, Estrada JC, Braith RW, Owens K, Conti CR. Enhanced external counterpulsation treatment improves arterial wall properties and wave reflection characteristics in patients with refractory angina. J Am Coll Cardiol 2006;48:1208 –1214.
5. Arora RR, Chou TM, Jain D, Fleishman B, Crawford L, McKiernan T, Nesto RW. The Multicenter Study of Enhanced External Counterpulsation (MUST-EECP): effect of EECP on exerciseinduced myocardial ischemia and anginal episodes. J Am Coll Cardiol 1999;33:1833–1840.
6. Werner D, Schneider M, Weise M, Nonnast-Daniel B, Daniel WG. Pneumatic external counterpulsation: a new noninvasive method to improve organ perfusion. Am J Cardiol 1999;84:950 – 952.
7. Traub O, Berk BC. Laminar shear stress: mechanisms by which endothelial cells transduce an atheroprotective force. Arterioscler Thromb Vasc Biol 1998;18:677– 685.
8. Lerner-Marmarosh N, Yoshizumi M, Che W, Surapisitchat J, Kawakatsu H, Akaike M, Ding B, Huang Q, Yan C, Berk BC, Abe J. Inhibition of tumor necrosis factor-_-induced SHP-2 phosphatase activity by shear stress: a mechanism to reduce endothelial inflammation. Arterioscler Thromb Vasc Biol 2003;23:1775–1781.
9. Adamopoulos S, Parissis J, Karatzas D, Kroupis C, Georgiadis M, Karavolias G, Paraskevaidis J, Koniavitou K, Coats AJ, Kremastinos DT. Physical training modulates proinflammatory cytokines and the soluble Fas/soluble Fas ligand system in patients with chronic heart failure. J Am Coll Cardiol 2002;39:653– 663.
10. Kervinen H, Manttari M, Kaartinen M, Makynen H, Palosuo T, Pulkki K, Kovanen PT. Prognostic usefulness of plasma monocyte/macrophage and T-lymphocyte activation markers in patients with acute coronary syndromes. Am J Cardiol 2004;94:993–996.
11. Ridker PM, Rifai N, Pfeffer M, Sacks F, Lepage S, Braunwald E. Elevation of tumor necrosis factor-alpha and increased risk of recurrent coronary events after myocardial infarction. Circulation 2000;
12. 101:2149 –2153.
13. Harrison DG, Widder J, Grumbach I, Chen W, Weber M, Searles C. Endothelial mechanotransduction, nitric oxide and vascular inflammation. J Intern Med 2006;259:351–363.
14. Chatzizisis YS, Coskun AU, Jonas M, Edelman ER, Feldman CL, Stone PH. Role of endothelial shear stress in the natural history of coronary atherosclerosis and vascular remodeling: molecular, cellular, and vascular behavior. J Am Coll Cardiol 2007;49:2379 –2393.
15. Masuda D, Nohara R, Hirai T, Kataoka K, Chen LG, Hosokawa R, Inubushi M, Tadamura E, Fujita M, Sasayama S. Enhanced external counterpulsation improved myocardial perfusion and coronary flow reserve in patients with chronic stable angina; evaluation by(13) Nammonia positron emission tomography. Eur Heart J 2001;22:1451–1458.
16. Akhtar M, Wu GF, Du ZM, Zheng ZS, Michaels AD. Effect of external counterpulsation on plasma nitric oxide and endothelin-1 levels. Am J Cardiol 2006;98:28 –30.
17. Chiu JJ, Lee PL, Lee CI, Chen LJ, Chen CN, Ko YC, Lien SC. Shear stress attenuates tumor necrosis factor-alpha-induced monocyte chemotactic protein-1 expressions in endothelial cells. Chin J Physiol 2002;45:169 –176. 302 The American Journal of Cardiology
